
| A. | 参加反应的HNO3物质的量为0.9mol | |
| B. | 原稀硝酸的物质的量浓度为3mol•L-1 | |
| C. | NaOH溶液的物质的量浓度为6mol•L-1 | |
| D. | 参加反应的金属质量为9g |
分析 镁、铝、铁合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Mg2+离子,根据电子守恒,金属共失去电子的物质的量为$\frac{6.72L}{22.4L/mol}$×(5-2)=0.9mol,
反应中金属失去电子的物质的量=硝酸根离子的物质的量=生成碱中的氢氧根离子的物质的量,即n(OH-)=n(NO3-)=0.9mol,根据c=$\frac{n}{V}$计算出氢氧化钠溶液的浓度;
反应后沉淀的质量为:金属质量+0.9mol×17g/mol=24.3g,则金属的质量为:24.3g-15.3g=9g;
参加反应的硝酸的物质的量为:n(HNO3)=n(NO3-)+n(NO)=0.3mol+0.9mol=1.2mol,根据c=$\frac{n}{V}$计算出计算出硝酸的物质的量浓度.
解答 解:将镁、铝、铁合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Mg2+离子,根据电子守恒,金属共失去电子的物质的量为:$\frac{6.72L}{22.4L/mol}$×(5-2)=0.9mol,
反应中金属失去电子的物质的量=硝酸根离子的物质的量=生成碱中的氢氧根离子的物质的量,即:n(OH-)=n(NO3-)=0.9mol,
A.参加反应的硝酸的物质的量为:n(HNO3)=n(NO3-)+n(NO)=0.3mol+0.9mol=1.2mol,故A错误;
B.参加反应的硝酸的物质的量为:n(HNO3)=n(NO3-)+n(NO)=0.3mol+0.9mol=1.2mol,硝酸的物质的量浓度为:c(HNO3)=$\frac{1.2mol}{0.3L}$=4mol/L,故B错误;
C.氢氧化钠溶液的物质的量浓度为:c(NaOH)=$\frac{0.9mol}{0.3L}$=3mol/L,故C错误;
D.反应后沉淀的质量=金属质量+0.9mol×17g/mol=27.2g,则金属的质量为:24.3g-15.3g=9g,故D正确;
故选D.
点评 本题考查了混合物计算、物质的量浓度的计算,题目难度中等,明确“反应中金属失去电子的物质的量=硝酸根离子的物质的量=生成碱中的氢氧根离子的物质的量”为解答本题的关键,注意电子守恒在计算中的应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.016 | B. | 1.00 | C. | 0.986 | D. | 2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3俗名石灰石,属于碳酸盐 | |
| B. | CaCO3属于含氧酸盐 | |
| C. | 实验室用煅烧CaCO3来制备二氧化碳 | |
| D. | CaCO3 属于难溶性的钙盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出大于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)=2CO2(g)△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b | |
| D. | 已知C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝加到硝酸汞溶液中:2Al+3Hg2+═2Al3++3Hg | |
| B. | 硫酸与氢氧化钡溶液混合:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| C. | 饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
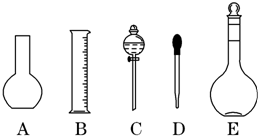 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com