
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3mol电子时,消耗H2SO4的质量是___g,产生氢气的体积(标准状况)_____L。
(2)反应②中_______作氧化剂,________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____。
(4)用双线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)_______。
(5)反应③中氧化产物与还原产物的物质的量之比为________。
【答案】147 33.6 H2SO4(浓) CuSO4 0.5mol 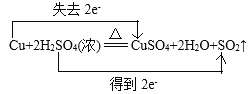 5:1
5:1
【解析】
(1)根据元素化合价升降总数等于反应中电子转移总数,结合n=![]() 、V=n·Vm计算;
、V=n·Vm计算;
(2)根据元素化合价升高,失去电子,该物质被氧化产生氧化产物,该物质作还原剂;元素化合价降低,获得电子,该物质被还原产生还原产物,该物质作氧化剂分析;
(3)由V=n·Vm计算SO2的物质的量,结合反应的H2SO4中元素化合价变化情况判断其作用;
(4)根据元素化合价升高,失去电子;元素化合价降低,获得电子,电子转移数目相等分析。
(5)根据还原剂失去电子,变为氧化产物;氧化剂获得电子,变为还原产物分析。
(1)①根据反应Fe+H2SO4(稀)=FeSO4+H2↑方程式可知:反应消耗1mol硫酸,转移2mol电子,产生1molH2,则当转移3mol电子时,消耗H2SO4的物质的量是1.5mol,其质量是m=1.5mol×98g/mol=147g,同时产生氢气1.5mol,其在标准状况下的体积V=1.5mol×22.4L/mol=33.6L。
②在反应Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑中,S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中的+4价,化合价降低,获得电子,被还原,H2SO4(浓)作氧化剂;Cu元素的化合价由反应前Cu单质的0价变为反应后CuSO4中的+2价,化合价升高,失去电子,被氧化,所以Cu是还原剂,CuSO4是氧化产物;
CuSO4+2H2O+SO2↑中,S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中的+4价,化合价降低,获得电子,被还原,H2SO4(浓)作氧化剂;Cu元素的化合价由反应前Cu单质的0价变为反应后CuSO4中的+2价,化合价升高,失去电子,被氧化,所以Cu是还原剂,CuSO4是氧化产物;
(3)当反应②中生成11.2LSO2气体(标准状况下)时,n(SO2)=![]() =0.5mol,在该反应中,每有2mol硫酸参加反应,被还原的H2SO4的物质的量是1mol,同时产生1molSO2,则反应产生0.5molSO2气体,被还原的H2SO4的物质的量是0.5mol。
=0.5mol,在该反应中,每有2mol硫酸参加反应,被还原的H2SO4的物质的量是1mol,同时产生1molSO2,则反应产生0.5molSO2气体,被还原的H2SO4的物质的量是0.5mol。
(4)在反应Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑中,Cu元素的化合价由反应前Cu单质的0价变为反应后CuSO4中的+2价,化合价升高2价,失去2e-;S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中的+4价,化合价降低2价,获得2e-,用双线桥法表示反应②电子转移的方向和数目为:
CuSO4+2H2O+SO2↑中,Cu元素的化合价由反应前Cu单质的0价变为反应后CuSO4中的+2价,化合价升高2价,失去2e-;S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中的+4价,化合价降低2价,获得2e-,用双线桥法表示反应②电子转移的方向和数目为: 。
。
(5)反应③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,Cl元素由反应前KClO3中的+5价变为反应后Cl2中的0价,化合价降低,获得电子5e-,KClO3是氧化剂,Cl2是还原产物;Cl元素由反应前KCl中的-1价变为反应后Cl2中的0价,化合价升高,失去电子5×e-,KCl是还原剂,Cl2是氧化产物;Cl2既是氧化产物又是还原产物,其中氧化产物与还原产物的物质的量之比为5:1。


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成分为![]() ,还含有
,还含有![]() 等杂质]为原料生产
等杂质]为原料生产![]() 的一种工艺流程如下:
的一种工艺流程如下:
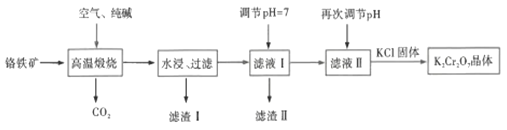
回答下列问题:
(1)![]() 可用氧化物的形式表示为___________。
可用氧化物的形式表示为___________。
(2)高温煅烧时![]() 分别与纯碱反应,固体产物分别为
分别与纯碱反应,固体产物分别为![]() 、___________;
、___________;![]() 发生反应的固体产物则为
发生反应的固体产物则为![]() 和一种红棕色固体,该反应的化学方程式为______________________;上述流程中,高温煅烧若在实验室中进行,适宜选用的仪器为___________(填标号)。
和一种红棕色固体,该反应的化学方程式为______________________;上述流程中,高温煅烧若在实验室中进行,适宜选用的仪器为___________(填标号)。
a.烧杯 b.蒸发皿 c.瓷坩埚 d.铁坩埚
(3)滤渣I的主要成分是___________;调节pH=7的目的是___________。
(4)再次调节pH是向滤液Ⅱ中加入![]() 使pH变小,溶液由黄色变为橙色,发生反应的离子方程式为______________________;能否用盐酸代替
使pH变小,溶液由黄色变为橙色,发生反应的离子方程式为______________________;能否用盐酸代替![]() 调节pH___________(填“能”或“否”)。
调节pH___________(填“能”或“否”)。
(5)向橙色溶液中加入![]() 固体,获得
固体,获得![]() 晶体的操作依次是加热浓缩、___________、过滤、洗涤、干燥。
晶体的操作依次是加热浓缩、___________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3 和NaHCO3的说法错误的是
A. 等质量Na2CO3 和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少
B. 将石灰水分别加入NaHCO3和Na2CO3中,前者不生成沉淀
C. 相同条件下Na2CO3 比NaHCO3更易溶于水
D. Na2CO3 固体中含少量NaHCO3,可用加热法除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
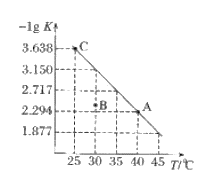
A. 该反应的△H>0
B. C点对应状态的平衡常数K(C)=103.638
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某XY3气体ag,它的摩尔质量为bg·mol1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为_____;
(2)该气体所含原子总数为____;
(3)该气体在标准状况下的体积为____;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____;将该溶液加水稀释至原体积的2倍后,再取出50 mL稀释后的溶液,则取出溶液的物质的量浓度____;
(5)标准状况下,相同体积的另一种气体CH4全部转化成CO2时转移的电子的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同一原子中,2p、3p、4p能级的轨道数依次增多
B. 电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则
C. ![]() 表示的原子能量处于最低状态
表示的原子能量处于最低状态
D. 正三价阳离子的电子排布式为1s22s22p63s23p63d5的元素在周期表中位于Ⅷ族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO· FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10molL1的NaOH溶液分别滴定20.00mL浓度均为0.10molL1的CH3COOH溶液和HCN溶液,所得滴定曲线如图所示,下列说法正确的是( )

A. 点①和点②所示溶液中:c(CH3COO)<c(CN)
B. 点④所示溶液中:c(Na+)>c(OH)>c(CH3COO)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO)c(CN)=c(HCN)c(CH3COOH)
D. 点③所示溶液中:c(CH3COO)+c(OH)=c(CH3COOH)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com