
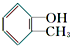
 互为同分异构体的所有芳香族化合物的结构简式:
互为同分异构体的所有芳香族化合物的结构简式:科目:高中化学 来源: 题型:
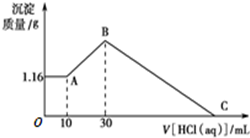 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

- 4 |
- 2 |
 ═□Mn2++□NO
═□Mn2++□NO- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入氧气的电极为正极 |
| B、参加反应的O2与C2H6的物质的量之比为7:2 |
| C、放电一段时间后,KOH的物质的量浓度将下降 |
| D、放电一段时间后,正极区附近溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有I-,不含有Cl- |
| B、可能含有Cl-、NO3-和I- |
| C、可能含有NO3- |
| D、一定不含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A、放出热量关系:a=92.4<b |
| B、N2的转化率:③>①>② |
| C、达平衡时氨气的体积分数:①>③ |
| D、三个容器内反应的平衡常数:③>①>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com