
【题目】下列关于Na2CO3和NaHCO3的叙述正确的是
A. Na2CO3俗名苏打,NaHCO3俗名纯碱
B. 受热时,NaHCO3比Na2CO3容易分解
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. Na2CO3和NaHCO3各lmol分别与足量的盐酸充分反应,产生CO2质量不相等
【答案】B
【解析】分析:Na2CO3俗名苏打、纯碱,NaHCO3俗名小苏打;NaHCO3受热易分解,Na2CO3受热不易分解;Na2CO3、NaHCO3溶液都呈碱性;1mol的Na2CO3和NaHCO3与足量盐酸反应产生CO2的质量相等。
详解:A项,Na2CO3俗名苏打、纯碱,NaHCO3俗名小苏打,A项错误;B项,Na2CO3比NaHCO3稳定,Na2CO3受热不易分解,NaHCO3受热易分解,NaHCO3受热分解的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑,B项正确;C项,Na2CO3、NaHCO3溶液都呈碱性,等物质的量浓度的Na2CO3溶液的碱性比NaHCO3强,C项错误;D项,1molNa2CO3和NaHCO3中含碳原子物质的量都为1mol,1mol的Na2CO3和NaHCO3与足量盐酸反应产生CO2物质的量都为1mol,质量都为44g,D项错误;答案选B。
Na2CO3+H2O+CO2↑,B项正确;C项,Na2CO3、NaHCO3溶液都呈碱性,等物质的量浓度的Na2CO3溶液的碱性比NaHCO3强,C项错误;D项,1molNa2CO3和NaHCO3中含碳原子物质的量都为1mol,1mol的Na2CO3和NaHCO3与足量盐酸反应产生CO2物质的量都为1mol,质量都为44g,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出. 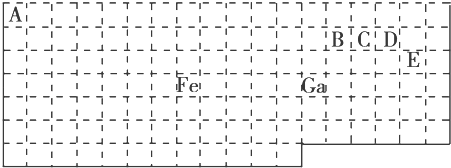
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为
(2)铁元素位于元素周期表的区;Fe和CO易形成配合物Fe(CO)5 , 在Fe(CO)5中铁的化合价为 .
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO互为等电子体的分子和离子分别为和(填化学式).
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 .
(5)根据VSEPR模型预测ED4﹣的空间构型为 . B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为(写2种).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
A.苏打﹣NaHCO3
B.胆矾﹣CuSO4
C.酒精﹣C2H5OH
D.生石灰﹣Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)工业上利用CO2与NH3混合,在一定条件下反应合成尿素: 2NH3(g)+CO2(g) ![]() CO(NH2)2(S)+H2O(g)△H
CO(NH2)2(S)+H2O(g)△H
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 .
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)正 d.容器中氨气的浓度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂. ZnSO4受热分解过程中各物质物质的量随温度变化关系如图1所示. 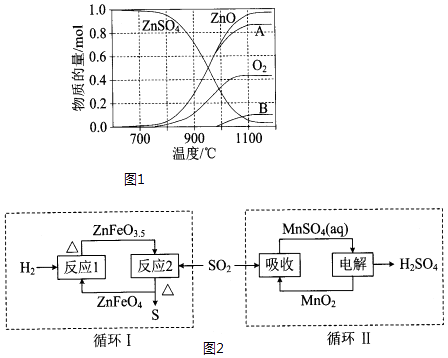
①写出700℃~980℃时发生反应的化学方程式: , 物质B的化学式是 . (A、B均为硫的氧化物)
②硫酸锌分解生成的SO2经图2中的两个循环可分别得到S和H2SO4 . 写出循环I中反应2的化学方程式:;循环II中用惰性电极电解,阳极反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的硫循环如下图所示,下列说法不正确的是

A. ①和②中硫元素均被氧化
B. ①是自然界形成酸雨的唯一原因
C. 含硫有机物和含硫无机物可相互转化
D. 控制化石燃料的使用可以减少SO2排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.常温常压下,2gD216O中含中子数、质子数、电子数均为NA
C.常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数小于0.1NA
D.同温、同压下,相同体积的氯气和氩气所含的原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,思考扇形元素周期表的填充规律,回答下列问题:
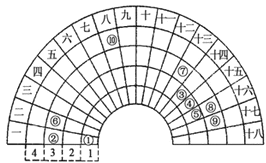
(1)写出⑩在长式周期表中的位置______________。
(2)元素⑥和⑦的原子序数相差________。
(3)元素②⑤⑧形成的简单离子半径由小到大的顺序是__________。
(4)元素①⑤可以形成多种10电子和18电子的粒子,写出其中符合下列要求的粒子的电子式为:4核18电子的分子________,10电子的阳离子__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com