

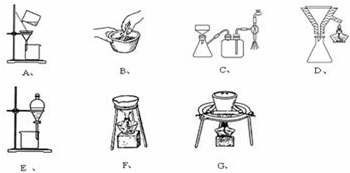
���� ��1�����ݷ�Ӧ����ʽ2CuSO4+4NaHCO3�TCu��OH��2•CuCO3��+3CO2��+2Na2SO4+H2O�ж�����ͭ��̼�����Ƶķ�Ӧ����
��2����Ӧ�����Һ�к�����������ӣ�����ͨ������ϴ��Һ���Ƿ�������������жϳ����Ƿ�ϴ����
��3���ٸ����������IJ�������ѡ��������
�ڼ���ͭ���ܽ���潵�Ͷ���С���¶Ƚ��ͻ��������壬����ȹ��ˣ�
�۸��ݲ��裨�����Ʊ�����ͭ�IJ�������ѡ����Ҫ��������
�ܼ�ѹ���˿ɼӿ�����ٶȣ����ܵõ��ϸ���ij��������ڳ����ķ��룬���������ڽ�״�����ķ��룬�ݴ˽����жϣ�
��4����ʽ̼��ͭ���ȶ����¶ȹ������ֽ⣻
��5�����ݼ���ͭ���Ҵ��е��ܽ�ȴ�С��������������ʷ�����
��6������n=$\frac{m}{M}$���������ͭ���塢̼�����Ƶ����ʵ�����Ȼ����ݲ�������������ɼ�ʽ̼��ͭ�����ʵ������ٸ��ݷ�ӦCu��OH��2•CuCO3+4HCOOH+5H2O�TCu��HCOO��2•4H2O+CO2����������������ɼ���ͭ���������������������ʣ�
��� �⣺��1������ͭ��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽΪ��2CuSO4+4NaHCO3�TCu��OH��2•CuCO3��+3CO2��+2Na2SO4+H2O�����Բ��裨�� ����ĥ������ע����ˮ��۲쵽�д������ݲ���������ɫ����������
�ʴ�Ϊ���д������ݲ���������ɫ����������
��2��������ϴ������ʽ̼��ͭ�����ϻ�ճ����������ӣ����Լ��������ϴ���ķ���Ϊ��ȡ���һ��ϴ�Ӻ����Һ�������Թܣ��μ�BaCl2��Һ������������ɫ������˵��������ϴ����
�ʴ�Ϊ��ȡ���һ��ϴ�Ӻ����Һ�������Թܣ��μ�BaCl2��Һ������������ɫ������˵��������ϴ����
��3����������������Һʱ��ѡ��ʹ�õ��ձ�������������������������
�ʴ�Ϊ���ձ�����������
�ڼ���ͭ���ܽ�����¶ȵ����߶���������ȴ�����о������������Ͳ��ʣ��������ȹ��ˣ�
�ʴ�Ϊ����ֹ����ͭ����������
�۸��ݼ���ͭ���Ʊ������֪����Ҫ��ѹ���ˡ����ȹ��˺�����װ�ã�������Ҫ��װ����C��D��F��
�ʴ�Ϊ��CDF��
�ܼ�ѹ����ֻ�����ڷ���������������ڷ��뽺�壬���Բ��ܲ��ü�ѹ���˵ķ������з�����ǣ�A��Na2SiO3�����������õĽ�״������������ϸ̼�����ˮ�Ļ��Һ��
�ʴ�Ϊ��AC��
��4�����ڼ�ʽ̼��ͭ���ȶ����¶ȹ��ߵ���Cu��OH��2?CuCO3�ֽ����ɺ�ɫ������ͭ��������̼�����ˮ��Ӱ������ʣ�
�ʴ�Ϊ���¶ȹ��ߵ���Cu��OH��2?CuCO3�ֽ⣻
��5������ͭ�������Ҵ����ܽ�Ƚ�С�����ܹ���ȥ����ͭ�����е��������ᣬ�Ӷ����ͼ���ͭ����ʧ��
�ʴ�Ϊ����ȥ���Ტ���ټ���ͭ������ʧ��
��6��12.5g����ͭ��������ʵ���Ϊ��$\frac{12.5g}{250g/mol}$=0.05mol��
9.5g̼�����Ƶ����ʵ���Ϊ��$\frac{9.5g}{84g/mol}$��0.113mol��
���ݷ�Ӧ2CuSO4+4NaHCO3�TCu��OH��2•CuCO3��+3CO2��+2Na2SO4+H2O��֪��̼�����ƹ�������Ӧ���ɵļ�ʽ̼��ͭ�����ʵ���Ϊ0.05mol��
���ݷ�ӦCu��OH��2•CuCO3+4HCOOH+5H2O�TCu��HCOO��2•4H2O+CO2����֪�����ɼ���ͭ�����ʵ���Ϊ0.05mol��
���Լ���ͭ�IJ���Ϊ��$\frac{7.91g}{226g/mol��0.05mol}$��100%=70%��
�ʴ�Ϊ��70%��
���� ����ͨ����ʽ̼��ͭ������ͭ������Ʊ���������������ʵ�鷽������Ʒ�������Ŀ�Ѷ��еȣ������漰��֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ�����ѧ���ķ�����������������ѧʵ�顢��ѧ������������һ�������Ϻõ����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪��CH3CH2OH+NaBr+H2SO4��Ũ��$\stackrel{��}{��}$ CH3CH2Br+NaHSO4+H2O��
��֪��CH3CH2OH+NaBr+H2SO4��Ũ��$\stackrel{��}{��}$ CH3CH2Br+NaHSO4+H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �μ�ʯ����Һ�Ժ�ɫ����Һ��Fe3+��NH4+��Cl-��CH3COO- | |
| B�� | pHֵΪ1����Һ��Cu2+��Na+��Mg2+��NO3- | |
| C�� | ˮ���������c��H+��=10-12mol/L����Һ��K+��HCO3-��Br-��Ba2+ | |
| D�� | ��������ΪNa2CO3����Һ��K+��Ca2+��NO3-��Al3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
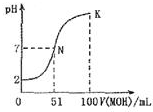 �����£���100mL0.01mol•L-1 HA��Һ����μ���0.02mol-1 MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯�������仯���Բ��ƣ�������˵���в���ȷ����
�����£���100mL0.01mol•L-1 HA��Һ����μ���0.02mol-1 MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯�������仯���Բ��ƣ�������˵���в���ȷ����| A�� | MOHΪһԪ���� | |
| B�� | MA ϡ��ҺPH��7 | |
| C�� | N��ˮ�ĵ���̶ȴ���K��ˮ�ĵ���̶� | |
| D�� | K���Ӧ����Һ��PH=10����C��MOH��+C��OH��-C��H+=0.01mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 25��ʱ����֪H2CO3?H++HCO3-K1=4.3��l0-7��
25��ʱ����֪H2CO3?H++HCO3-K1=4.3��l0-7��| A�� | W����ʾ����Һ�У�c��Na+��+c��H+��=2c��CO32-��+c��OH-��+c��HCO3-�� | |
| B�� | pH=4����Һ�У�c��H2CO3��+c��HCO3-��+c��CO32-��=0.1 mol•L-1 | |
| C�� | pH=8����Һ�У�c��H+��+c��H2CO3��+c��HCO3-��=c��OH-��+c��Cl-�� | |
| D�� | pH=11����Һ�У�CO32-+H2O?HCO3-+OH-K=1.8��l0-4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
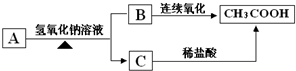
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
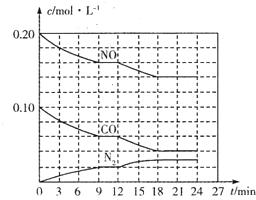 Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ�����������Ч���ƿ����е������̼����������������Ե���Ϊ��Ҫ��
Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ�����������Ч���ƿ����е������̼����������������Ե���Ϊ��Ҫ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com