
| A. | 3NO2+H2O═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2↑ |
分析 A.反应中只有N元素的化合价变化,生成2HNO3被氧化为氧化产物,生成NO被还原为还原产物;
B.反应中FeS2中Fe、S化合价都升高为还原剂,生成2Fe2O3和8SO2为氧化产物,O2中O化合价降低为氧化剂,生成2Fe2O3和8SO2也为还原产物;
C.反应中2NH3中N化合价升高为还原剂,生成N2为氧化产物,Cl2中Cl化合价降低为氧化剂,生成6NH4Cl为还原产物;
D.反应中2Na中Na元素的化合价升高为还原剂,生成2NaNH2为氧化产物,2NH3中H化合价降低为氧化剂,生成H2为还原产物.
解答 解:A.在反应3NO2+H2O═2HNO3+NO中,2NO2→2HNO3,是被氧化的过程,NO2→NO是被还原的过程,被氧化的N和被还原的N的物质的量之比2:1,氧化产物与还原产物的物质的量之比为2:1,故A错误;
B.反应中FeS2中Fe、S化合价都升高为还原剂,生成2Fe2O3和8SO2为氧化产物,O2中O化合价降低为氧化剂,生成2Fe2O3和8SO2也为还原产物,所以氧化产物和还原产物的物质的量之比为1:1,故B正确;
C.反应中2NH3中N化合价升高为还原剂,生成N2为氧化产物,Cl2中Cl化合价降低为氧化剂,生成6NH4Cl为还原产物,所以氧化产物和还原产物的物质的量之比为1:6,故C错误;
D.反应中2Na中Na元素的化合价升高为还原剂,生成2NaNH2为氧化产物,2NH3中H化合价降低为氧化剂,生成H2为还原产物,所以氧化产物和还原产物的物质的量之比为2:1,故D错误;
故选:B.
点评 本题考查氧化还原反应,题目难度不大,解答本题的关键是判断元素化合价变化的情况.


科目:高中化学 来源: 题型:解答题
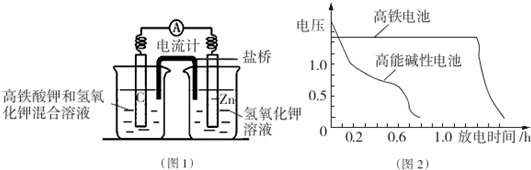
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4C1溶液因水解而显酸性,故NH4C1是弱电解质 | |
| B. | 纯碱溶液因水解而显碱性,水解的离子方程式为:CO32-+H2O?H2CO3+2OH- | |
| C. | 可乐因含碳酸而显酸性,电离方程式为:H2CO3?CO32-+2H+ | |
| D. | 配制FeC13 溶液时,先将FeC13 溶于较浓的盐酸中,然后再加水稀释到所需浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 同温同压下,H2(g)+Cl2=2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 反应A(g)?2B(g),若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则该反应的△H=(Ea-Eb) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
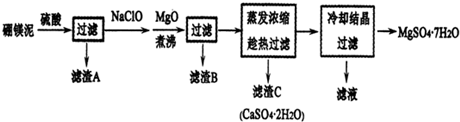
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
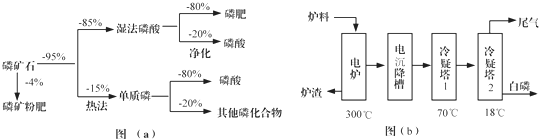
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
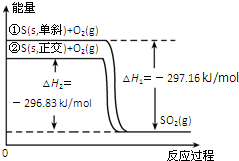
| A. | 单斜硫转化为正交硫的反应是吸热反应 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①表示断裂1mol O2中的共价键所吸收的能量比形成lmolSO2中的共价键所放出的能量少297.16 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com