
【题目】22.4LCl2和1molCl2相比,下列说法中正确的是( )
A.体积一定相等B.分子数目一定相等
C.密度可能相等D.质量一定相等
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以![]() 固体为电解质传递
固体为电解质传递![]() ,其基本结构如图,电池总反应可表示为
,其基本结构如图,电池总反应可表示为![]() ,下列有关说法正确的是
,下列有关说法正确的是![]()
![]()
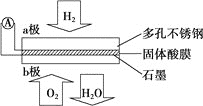
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为![]()
C. 每转移![]() 电子,消耗标准状况下
电子,消耗标准状况下![]()
D. ![]() 由a极通过固体酸电解质传递到b极
由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅及其化合物可用于蓄电池,耐酸设备及 X 射线防护材料等。回答下 列问题:
①铅是碳的同族元素,比碳多 4 个电子层。铅的原子结构示意图为_____;铅的最高价氧化物对应水化物的酸性比碳酸的______(填“强”或“弱”)。
②PbO2 与浓盐酸共热生成黄绿色气体,反应的化学方程式为_____。
③铅蓄电池放电时的正极反应式为_____ ,当电路中有 2mol 电子转移时,理论上两电极质量变化的差为_____g。
(2)NO2、O2 和熔融 NaNO3 可制作燃料电池,其原理见下图,石墨Ⅰ为电池的_____极;该电池在使用过程中石墨Ⅰ电极上生成氧化物 Y,其电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,容积为5L的某密闭容器中将1mol A和2mol B发生如下反应:A(s)+2B(g) ![]() C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L。下列叙述不正确的是( )
C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L。下列叙述不正确的是( )
A. 在5min内该反应用C的浓度变化表示的反应速率为0.02mol/(L·min)
B. 5min时,容器内D的浓度为0.2mol/L
C. 5min时容器内气体总的物质的量为3mol
D. 当容器内压强保持恒定时,该可逆反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1 mol CH4 转移2 mol 电子
3H2+CO,每消耗1 mol CH4 转移2 mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-===2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 用浓盐酸分别和KMnO4、KClO3反应制备l mol氯气,转移的电子数均为2NA
D. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化硫的下列叙述中,正确的是( )
A.能使含有酚酞的氢氧化钠溶液褪色,体现了二氧化硫的漂白性
B.二氧化硫能使石蕊溶液先变红色再褪色,体现了二氧化硫的酸性和漂白性
C.二氧化硫、氯气都能使品红溶液褪色,但原理不同
D.二氧化硫通入足量氯化钙溶液,能生成白色的亚硫酸钙沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com