
| 操作 | 现象 | 结论 |
| 将有色鲜花瓣放入干燥的Cl2中 | 过一会儿鲜花瓣褪色 | (1)湿润的氯气具有漂白性 |
| 将干燥的有色布条放入新制的氯水中 | 过一段时间该布条褪色 | |
| 将有色干花瓣放入干燥的Cl2中 | (2)不褪色 | (4)干燥的氯气不具有漂白性 |
| 将干燥的有色布条放入干燥的Cl2中 | (3)不褪色 |
分析 氯气不具有漂白性,但与水反应生成具有漂白性的次氯酸,氯气可使鲜花、湿润的有色布条褪色,以此解答该题.
解答 解:氯气与水反应生成盐酸和次氯酸,次氯酸具有强氧化性和漂白性,则鲜花、有色布条褪色,干燥的氯气不具有漂白性,与有色干花、布条不反应,不褪色,
故答案为:
| 操作 | 现象 | 结论 |
| 将有色鲜花瓣放入干燥的Cl2中 | 过一会儿鲜花瓣褪色 | (1)湿润的氯气具有漂白性 |
| 将干燥的有色布条放入新制的氯水中 | 过一段时间该布条褪色 | |
| 将有色干花瓣放入干燥的Cl2中 | (2)不褪色 | (4)干燥的氯气不具有漂白性 |
| 将干燥的有色布条放入干燥的Cl2中 | (3)不褪色 |
点评 本题考查氯气的性质探究,侧重于学生的分析、实验能力的考查,注意把握氯气、次氯酸的性质,把握实验的原理,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2通入过量氨水中:SO2+NH3•H2O=NH4++HSO3- | |
| B. | (CH3COO)2Ba溶液中滴入稀硫酸:Ba2++SO42-=BaSO4↓ | |
| C. | 以Ag作电极,电解AgNO3溶液:4Ag++2H2O=4Ag↓+O2↑+4H+ | |
| D. | AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ||||
| 三 | ⑦ | ④ | ⑤ | ⑥ | |||
| 四 | ⑧ | ⑨ | ⑩ |
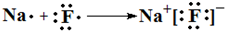 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
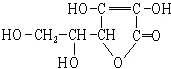
| A. | 分子式为C6H8O6 | B. | 易起氧化及加成反应 | ||
| C. | 可以溶于水 | D. | 在碱性溶液中能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol | B. | 0.6 mol | C. | 0.7 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )| A. | N4和N2互为同素异形体,两者之间的转化为非氧化还原反应 | |
| B. | 1mol N4分子的总能量比1mol N2分子的总能量高,说明相同条件下N4分子化学性质更稳定 | |
| C. | N4气体转化为N2的热化学方程式为:N4(g)═2N2(g),△H=-882 kJ•mol-1 | |
| D. | 白磷(P4)的熔、沸点比N4分子的高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com