
| A. | CO2H2O | B. | C2H4 CH4 | C. | Cl2 C2H2 | D. | NH3HCl |
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A.CO2含有O=C,为极性键,二氧化碳是直线分子,呈对称结构,是非极性分子;H2O含有O-H,为极性键,水是V型分子,是极性分子,故A错误;
B.C2H4、CH4 都含有C-H,是极性键,乙烯分子结构是平面对称型结构,甲烷是正四面体结构,二者正负电荷重心都能重合,都是非极性分子,故B正确;
C.Cl2含有Cl-Cl,为非极性键,是非极性分子;C2H4含有C-H,是极性键,乙炔分子结构是直线型分子,是非极性分子,故C错误;
D.NH3、HCl二者是由极性键构成的极性分子,故D错误,
故选B.
点评 本题考查键的极性和分子的极性的判断,题目难度中等,注意共价键极性和分子极性的判断方法.


科目:高中化学 来源: 题型:选择题
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
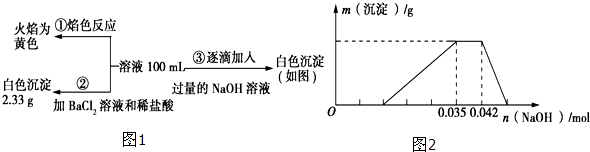
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4、BaCl2、HNO3 | B. | KNO3、Na2CO3、CaCl2 | ||
| C. | MgSO4、NaOH、H2SO4 | D. | AgNO3、NaCl、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03 mol/L | B. | 0.04 mol/L | C. | 0.05 mol/L | D. | 0.06mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com