
| A. | 纸层析以滤纸作为惰性支持物 | |
| B. | 应沿试管壁小心地将展开剂慢慢倒入试管底部 | |
| C. | 纸层析的实质是试样中的各组分在两相之间产生不同分配 | |
| D. | 点样后的滤纸需晾干后,才能将其浸入展开剂中 |
分析 层析技术是利用混合物中各组分的物理化学性质(分子的形状和大小,分子极性,吸附力,分子亲和力,分配系数等)的不同,使各组分以不同程度分布在固定相和流动相中,当流动相流过固定相时,各组分以不同的速度移动,而达到分离的技术.
解答 解:A.常用滤纸作载体,滤纸上所吸收的水分作固定相,有机溶剂作流动相,故A正确;
B.展开剂不能粘到试管内壁上,则不能沿试管壁小心地将展开剂慢慢倒入试管底部,故B错误;
C.纸层析的实质是试样中的各组分在两相之间产生不同分配,当流动相流过固定相时,各组分以不同的速度移动,而达到分离的目的,故C正确;
D.用毛细管取样品溶液,轻轻点样于原点上,晾干后,重复3-5次,才能将其浸入展开剂中,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握纸层析法利用在不同溶剂中的扩散速率不同分离原理为解答的关键,把握实验操作的注意事项即可解答,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①② | C. | 只有①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
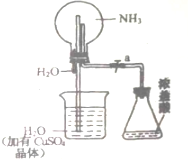 如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.
如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO4的酸性比HNO3弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒(Se)化氢比硫化氢稳定 | D. | 氢氧化钡比氢氧化钙的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4与Cl2光照取代反应 | B. | 乙醇与浓硫酸共热 | ||
| C. | 乙炔在空气中的燃烧反应 | D. | 乙烯与氯化氢加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-) | |
| B. | 若向溶液中不断加水稀释,水的电离程度增大 | |
| C. | 若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a | |
| D. | 若向该溶液中加入等体积CaCl2溶液后能够产生沉淀,则CaCl2溶液的最小浓度应该大于2.4×10-8 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
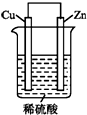 如图是Zn和Cu形成的原电池,回答下列问题:
如图是Zn和Cu形成的原电池,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com