
分析 用惰性电极电解一定物质的量浓度的CuSO4溶液,阳极上OH-放电生成O2、阴极上Cu2+放电生成Cu,所以析出物质相当于CuO,要想使溶液恢复原状,应该采用“析出什么加入什么”的原则.
解答 解:用惰性电极电解一定物质的量浓度的CuSO4溶液,阳极上OH-放电生成O2、阴极上Cu2+放电生成Cu,所以阴极反应式为Cu2++2e-=Cu;
则析出物质相当于CuO,要想使溶液恢复原状,应该采用“析出什么加入什么”的原则,则需要加入的物质是CuO,也可以加入CuCO3,因为CuCO3和酸反应生成铜离子、二氧化碳和水,所以还相当于加入CuO,
故答案为:Cu2++2e-=Cu;CuO或CuCO3.
点评 本题考查电解原理,为高频考点,明确各个电极发生的反应是解本题关键,难点是电极反应式的书写,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氨气具有还原性,可用于检查HCl泄漏 | |
| B. | 浓硫酸具有脱水性,可用于干燥CO2 | |
| C. | 氧化铝具有高熔点,可用于生产耐火砖 | |
| D. | Cl2有酸性,可与烧碱反应制备含氯消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +1 | C. | 0 | D. | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
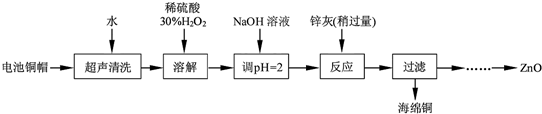
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的炼制过程不都是化学变化 | |
| B. | 煤中含有苯和甲苯,可用蒸馏的方法将它们分离 | |
| C. | 煤是工业上获得芳香烃的一种重要原料 | |
| D. | 煤通过液化和气化处理能减少环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | |
| B. | 明矾净水:Al3++3H2O?Al(OH)3+3H+ | |
| C. | 90℃时,测得纯水中Kw=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| D. | 用热的纯碱溶液可以清洗油污:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
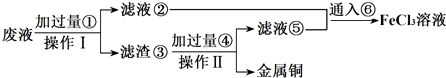
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
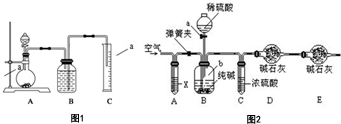 制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com