
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用子炼铁等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=akJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=bkJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________。
(2)将CO2转化为甲醇的热化学方程式为: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。
①下列情况能说明反应已达平衡状态的是________(填字母)。
A.容器内气体密度不变 B.容器内气体总压强保持不变
C.绝热恒容时,平衡常数不变 D.v正(CH3OH)=3v逆(H2)
②反应过程中测得甲醇的体积分数α(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH______0(填“>”、“<”或“=”)。
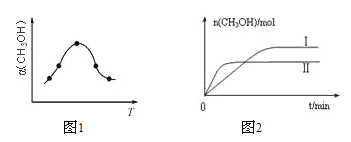
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
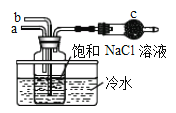
①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在_____处通入NH3气体,然后再在_______处通入CO2气体。
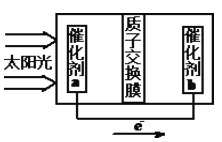
②人工光合作用能够借助太阳能用CO2和水制备化学原料,右图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:________________。
【答案】(1)Fe2O3(s)+3CO( g)=2Fe(s) +3CO2(g) △H=(a-3b)kJ/mol
(2)① BC ②< ③ > (3)①a b ②CO2+2e-+2H+=HCOOH
【解析】(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=akJmol-1,②C(石墨)+CO2(g)=2CO(g)△H2=bkJmol-1,依据盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=(a-3b)kJmol-1;
(2)①A.体积和质量始终不变,则密度始终不变,无法判断是平衡状态,故A错误;B.反应前后气体的物质的量不等,容器内气体总压强保持不变,说明气体总的物质的量一定,可判断是平衡状态,故B正确;C.平衡常数不变,说明温度不变,在绝热恒容时温度不变,是平衡状态,故C正确;D.当v正(CH3OH)=v逆(H2)时表明平衡状态,故D错误;答案为BC;②由图可知最高点反应到达平衡,达平衡后,温度越高,α(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0;
③由图2可知,温度TⅠ<TⅡ,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,则△H<0,升高温度,平衡向逆反应移动,所以KⅠ>KⅡ;
(3)①“侯氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3的,在这一实验过程中,由于C02在水中的溶解度较小,而NH3的溶解度较大,为防止倒吸,b管通C02,a管通NH3,所以要在食盐水先a管通NH3然后再b管通C02;
②由图可知,左室投入是水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室催化剂b表面通入二氧化碳,酸性条件下生成HCOOH,电极反应式为CO2+2H++2e-=HCOOH。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列有关金属键的叙述错误的是( )。
A. 金属键没有饱和性和方向性
B. 金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C. 金属键中的电子属于整块金属
D. 金属的性质和金属固体的形成都与金属键有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯如表物质(括号内物质为杂质),所选用的除杂试剂和分离方法正确的是( )
被提纯的物质 | 除杂试剂 | 分离方法 | |
A | 乙酸乙酯(乙醇) | 乙酸 | 加热回流 |
B | 乙烷(乙烯) | 酸性KMnO4 | 洗气 |
C | 乙醇(乙酸) | 新制氧化钙 | 蒸馏 |
D | 苯(溴) | 碘化钾溶液 | 分液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 明矾与水反应成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 当光束通过鸡蛋清水溶液时,能观察到丁达尔效应
C. 烟、云、雾、豆浆、碘酒等分散系中分散质粒子直径均在1-100nm范围内
D. 胶体不一定是透明的,但胶体粒子都能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)![]() 2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
A. z=2 B. 2 s后,容器内的压强是初始的7/8倍
C. 2 s后,B的浓度为0.5 mol/L D. 2 s时C的体积分数为2/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质固态时,其晶体类型完全正确的一组是( )
离子晶体 | 分子晶体 | 原子晶体 | 金属晶体 | |
A | NH4NO3 | SO3 | 水晶 | K |
B | H2SO4 | 硫 | 石墨 | Fe |
C | KOH | CH3COOH | Ar | Cu |
D | Ba(OH)2 | 玻璃 | 金刚石 | Mg |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用。其工作流程如下图所示:

已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42-![]() 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42-)=1.6mol/L,c(CO32-)=0.1mol/L,则PbCO3中____(填“是”或“否”)混有PbSO4。
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发 生反应:PbSO4 + 3OH- = HPbO2-+ SO42- +H2O。

①a与外接电源的________极相连。
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为___________。
③与传统无膜固相电解法相比,使用钠离子交换膜可以 提高Pb元素的利用率,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:

①2SO2(g)+O2(g)![]() 2SO3(g)的△H________0(填“>”或“<”),
2SO3(g)的△H________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是________。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com