
| 0.2 |
| n |
| 4.6 | ||
|
| 0.2 |
| n |
| 4.6 | ||
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的摩尔质量等于其相对分子(原子)质量 |
| B、0.012 kg 12C中所含的碳原子数为NA |
| C、“物质的量”是国际单位制中的一个基本单位 |
| D、1mol任何物质都含有约6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
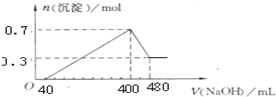
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 拟用右图装置制取并收集下表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂),能达到实验目的是( )
拟用右图装置制取并收集下表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂),能达到实验目的是( )| 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | 饱和NaCl |
| C | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3 |
| D | NH3 | 浓氨水 | NaOH固体 | 浓硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
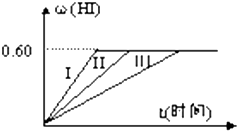 在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0并达平衡.HI的体积分数ω(HI)随时间变化如图曲线(II)所示.若改变反应条件,HI的体积分数ω(HI)变化曲线如右图所示,则(I)和(III)改变的条件分别是( )
在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0并达平衡.HI的体积分数ω(HI)随时间变化如图曲线(II)所示.若改变反应条件,HI的体积分数ω(HI)变化曲线如右图所示,则(I)和(III)改变的条件分别是( )| A、①⑤,③ | B、②⑤,④ |
| C、③⑤,② | D、③⑤,④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com