
【题目】氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,见光易分解,在潮湿空气中易被氧化,难溶于水。
(1)实验室保存新制CuCl晶体的方法是_________________。
(2)已知:Cu(s)+Cl2(g)=CuCl2(s) △H1=-218.8kJ/mol
2Cu(s)+O2(g)=2CuO(s) △H2=-310.6kJ/mol
2CuCl2(s)=2CuCl(s)+Cl2(g) △H3=+152.3kJ/mol
则反应4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)的△H=____kJ/mol。
(3)利用CuCl难溶于水的性质,可以除去废水中的Cl-。向含Cl-的废水中同时加入Cu和CuSO4,溶液中平衡时相关离子浓度关系如图所示。[已知:pc(离子)=-lgc(离子)]

①除去废水中Cl-的离子方程式为_________________。
②Ksp(CuCl)=___________。
③已知:Cu+Cu2+![]() 2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
(4)T℃时,用H2还原CuCl制备活性铜:H2(g)+2CuCl(s)![]() 2Cu(s)+2HCl(g),达到平衡时,H2的转化率(
2Cu(s)+2HCl(g),达到平衡时,H2的转化率(![]() )为80%。反应速率v=v正-v逆=
)为80%。反应速率v=v正-v逆=![]() ,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当
,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当![]() =60%时,
=60%时,![]() =________(保留1位小数)。
=________(保留1位小数)。
(5)CuCl溶于浓氨水的反应原理为CuCl+2NH3·H2O![]() [Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
[Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
【答案】干燥密封、避光保存 -177.6 Cu+Cu2++2Cl-=2CuCl 2×10-7 Kˊ=![]() =
=![]() =1.9×107,反应完全进行 3.2 温度过低,反应速率较慢;温度过高,NH3H2O分解
=1.9×107,反应完全进行 3.2 温度过低,反应速率较慢;温度过高,NH3H2O分解
【解析】
(1)根据CuCl见光易分解,在潮湿空气中易被氧化,难溶于水确定保存方法;
(2)根据盖斯定律,将方程式叠加,就可得到待求热化学方程式的反应热;
(3)①Cu、Cu2+发生氧化还原反应产生Cu+,Cu+与Cl-结合形成CuCl沉淀;
②Ksp(CuCl)=c(Cu+)c(Cl-),由pc(Cl-)=3.7及对应的p(Cu)计算;
③利用氧化还原反应的价态规律,即可写出Cu与Cu2+的反应,利用平衡常数及Ksp(CuCl)的大小与反应完全时的K的大小分析判断;
(4)先根据平衡时氢气的转化率为80%计算出![]() ,根据温度不变,
,根据温度不变,![]() ,然后将
,然后将![]() 再带入计算H2转化率为60%时的速率公式计算;
再带入计算H2转化率为60%时的速率公式计算;
(5)从化学反应速率和NH3·H2O的稳定性分析判断。
(1)由于CuCl难溶于水,在潮湿空气中易被氧化,见光易分解,所以在实验室保存新制CuCl晶体的方法是干燥密封、避光保存;
(2)由于物质含有的能量与反应途径无关,只与物质的始态和终态有关,所以①Cu(s)+Cl2(g)=CuCl2(s) △H1=-218.8kJ/mol
②2Cu(s)+O2(g)=2CuO(s) △H2=-310.6kJ/mol
③CuCl2(s)=2CuCl(s)+Cl2(g) △H3=+152.3kJ/mol
则②-①×2--③×2,整理可得:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)的△H=-177.6kJ/mol。
(3) ①在溶液中Cu、Cu2+、Cl-发生氧化还原反应,形成CuCl沉淀,反应的离子方程式为:Cu+Cu2++2Cl-=2CuCl;
②在pc(Cl-)=3.7点,c(Cl-)=2×10-4mol/L,pc(Cu+)=3,c(Cu+)=10-3 mol/L,由于Ksp(CuCl)=c(Cu+)c(Cl-)=1×10-3 mol/L×2×10-4mol/L=2×10-7mol2/L2;
③加入的单质铜具有还原性,而硫酸铜中二价铜具有氧化性,利用氧化还原反应与CuCl难溶于水即可除去氯离子,即Cu+Cu2++2Cl-=2CuCl;根据反应方程式可得平衡常数Kˊ=![]() =1.9×107,化学平衡常数的值大于105,所以反应可以完全进行;
=1.9×107,化学平衡常数的值大于105,所以反应可以完全进行;
(4)发生反应 H2(g)+2CuCl(s)![]() 2Cu(s)+2HC1(g),假设开始时氢气的物质的量为1mol,
2Cu(s)+2HC1(g),假设开始时氢气的物质的量为1mol,
n(开始) (mol) 1 0
n(平衡) (mol)0.2 2×0.8=1.6
x(H2)=![]() ,x(HCl)=
,x(HCl)=![]() ,反应达到平衡时,v(正)= v(逆),所以
,反应达到平衡时,v(正)= v(逆),所以![]() ,
,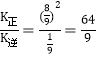 ;
;
发生该反应,假设开始时氢气的物质的量为1mol,H2转化率是60%
则 H2(g)+2CuCl(s)![]() 2Cu(s)+2HC1(g),
2Cu(s)+2HC1(g),
n(开始) (mol) 1 0
t时(mol) 0.4 2×0.6=1.2
x(H2)=![]() ,x(HCl)=
,x(HCl)=![]() ,
,![]() =
= =
=![]() =3.2;
=3.2;
(5)该反应控制温度为70~80℃,是由于温度过低,反应速率较慢,达到平衡所需要的时间很长;若温度过高,NH3H2O又会发生分解反应,不利用反应的正向进行。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 2.3gNa投入到97.7g水中形成溶液的质量分数为2.3%
B. 25g CuSO4.5H2O溶于水配成1L溶液,溶质的物质的量浓度为0.1mol/L
C. Na2O2溶于水后溶质未发生改变
D. 标准状况下,22.4 L的SO3中所含分子数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
沸点(℃) | -252.8 | -146 | -103.7 | -47.4 | 80.10 | 110.63 | 4827 |
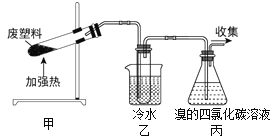
(1)甲试管中最终残留物是_____________。它有多种用途,如下列转化就可制取聚乙炔。写出反应②的化学方程式__________________________ 。
![]()
(2)乙中试管收集到的两种产品中,有一种能使酸性高锰酸钾溶液褪色的物质,该物质为__________。
(3)丙中锥形瓶观察到的现象_____________________________________。反应的化学方程式是__________________________、_________________________。
(4)经溴的四氯化碳溶液充分吸收,最后收集到的气体是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的信息判断,下列说法错误的是

A. 第①组反应的氧化产物为O2
B. 第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C. 第③组反应中生成3mol C12,转移6mol电子
D. 氧化性由强到弱的顺序为C1O3- >C12>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过硫酸钠(Na2S2O8)常用作漂白剂、氧化剂等。某研究小组利用下图装置制备Na2S2O8并探究其性质(加热及夹持仪器略去)。
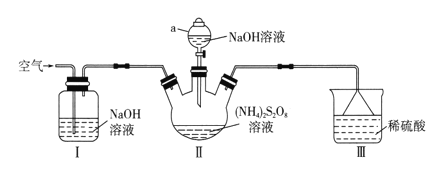
已知:①(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3+2H2O
Na2S2O8+2NH3+2H2O
②2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
(1)仪器a的名称是________________。装置I中NaOH溶液的作用是___________。
(2)装置II发生反应的同时,需要持续通入空气的目的是_______________________。
(3)装置III的作用是__________________________。
(4)Na2S2O8溶液与铜反应只生成两种盐,且反应先慢后快。
①该反应的化学方程式为___________________________。
②某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用。设计实验方案验证该推测是否正确___________。(供选试剂:Cu、Na2S2O8溶液、CuSO4溶液、Cu(NO3)2溶液、蒸馏水)
(5)测定产品纯度:称取0.2500g样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用0.1000mol/LNa2S2O8标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为19.50mL。(已知:I2+2S2O32-=S4O62-+2I-)
①选用的指示剂是____________;达到滴定终点的现象是______________________。
②样品的纯度为___________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
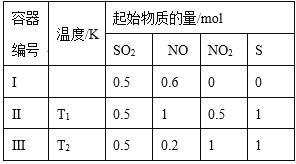
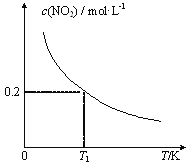
A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H2AsO4和单质硫,写出发生反应的化学方程式 _____________________________________________;该反应需要在加压下进行,原因是 _______________________________________
(3)已知:As(s)+3/2H2(g)+2O2(g)=H3AsO4 (s) △H1
H2(g)+1/2O2(g)=H2O(l) △H2
2As(s)+5/2O2(g)=As2O5(s) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4 (s)的△H= ________________________
(4)298K时,将20mL 3xmol·L-1Na3AsO3、20mL 3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.
AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)与反应时间(t)的关系如图所示.
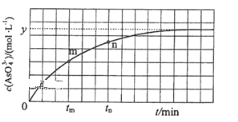
①下列可判断反应达到平衡的是 ______ (填标号).
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时,v正______v逆 ( 填“大于”“小于”或“等于”)
③tm时,v逆 ______tn时v逆(填“大于”“小于”或“等于”),理由是 ____________________
④若平衡时溶液pH=14,则该反应的平衡常数K为 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4H2O)是一种强还原性的碱性液体,是一种用途广泛的化工原料,实验室用如图装置制备(部分装置省略)。回答下列问题:
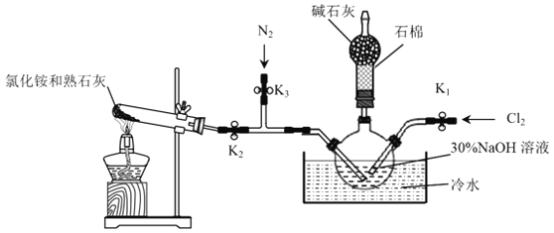
(1)步骤1关闭K2、K3,打开K1,制备NaClO;步骤2关闭______,打开_______,通入N2一段时间;关闭K3,打开K2,通入NH3,制备N2H4H2O。
(2)盛放碱石灰的仪器的名称为____________,碱石灰的作用_________________。
(3)步骤2中通入N2一段时间的原因是______________________。
(4)本装置中制备氨气的化学方程式是____________________________。
(5)NH3与NaClO反应生成N2H4H2O的化学方程式为______________________。
(6)已知:N2H4H2O+2I2=N2↑+4HI+H2O,实验室用碘标准溶液测定N2H4H2O粗产品的纯度。若称取N2H4H2O粗产品(其它杂质不与I2反应)2.000g,加水配成250.00mL溶液,移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液,用0.3000molL-1的碘标准溶液进行滴定,碘标准溶液盛放在______(填“酸式”或“碱式”)滴定管中。达到终点的现象是___________。实验测得消耗碘标准溶液的平均体积为20.00mL,则粗产品中水合肼的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com