
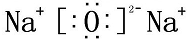 ,
,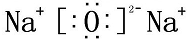 ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 丙烯酰胺是一种重要的有机合成的中间体.它的球棍模型如图所示:(图中球与球之间连线表示单键或双键,不同颜色球表示不同原子:C、H、O、N)
丙烯酰胺是一种重要的有机合成的中间体.它的球棍模型如图所示:(图中球与球之间连线表示单键或双键,不同颜色球表示不同原子:C、H、O、N)| Ⅰ |
| Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.
CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下28g乙烯中所含极性键的数目为4NA |
| B、将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+ |
| C、标准状况下,22.4L甲醇的分子数中所含羟基数为NA |
| D、10L pH=1的硫酸溶液中含有的H+离子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com