
分析 由硫酸与氢氧化钙的反应为:①2H+(aq)+SO42-(aq)+Ca2+(aq)+2OH-(aq)=CaSO4↓(s)+2H2O(l)△H=-130.3 kJ•mol-1,
HCl(aq)与NaOH(aq)反应的△H=-57.3kJ/mol,则②H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,
生成硫酸钙沉淀的反应为:③SO42-(aq)+Ca2+(aq)=CaSO4↓(s)△H,
根据盖斯定律,①-②×2可得:SO42-(aq)+Ca2+(aq)=CaSO4↓(s)△H=(-130.3 kJ•mol-1)-(-57.3 kJ•mol-1)×2=-15.7kJ/mol,由于钙离子与硫酸根离子之间存在热效应,由此分析解答.
解答 解:由硫酸与氢氧化钙的反应为:①2H+(aq)+SO42-(aq)+Ca2+(aq)+2OH-(aq)=CaSO4↓(s)+2H2O(l)△H=-130.3 kJ•mol-1,
HCl(aq)与NaOH(aq)反应的△H=-57.3kJ/mol,则②H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,
生成硫酸钙沉淀的反应为:③SO42-(aq)+Ca2+(aq)=CaSO4↓(s)△H,
根据盖斯定律,①-②×2可得:SO42-(aq)+Ca2+(aq)=CaSO4↓(s)△H=(-130.3 kJ•mol-1)-(-57.3 kJ•mol-1)×2=-15.7kJ/mol,由于钙离子与硫酸根离子之间存在热效应,导致△H2≠2△H1,故答案为:由于钙离子与硫酸根离子之间存在热效应.
点评 本题考查了反应热大小的比较,题目难度中等,学生注意钙离子与硫酸根离子之间生成硫酸钙存在热效应,试题培养了学生的灵活运用能力.


科目:高中化学 来源: 题型:选择题
| A. | 普通玻璃、水泥成分中都含有这三种元素 | |
| B. | 三者的单质在空气中均能稳定存在 | |
| C. | 电解熔融状态的SiO2和Al2O3可以制得Si、Al,且都有氧气生成 | |
| D. | 氧元素与另外两种元素形成的二元化合物都能与NaOH的浓溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
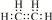 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
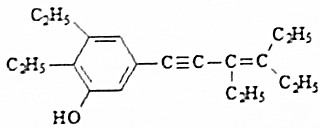
| A. | 该有机物在水中的溶解度小于苯酚在水中的溶解度 | |
| B. | 1mol该有机物可与5mol Br2发生反应 | |
| C. | 该有机物中所有碳原子有可能共面 | |
| D. | 1分子该有机物中有7个碳原子处于同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
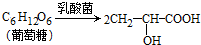
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
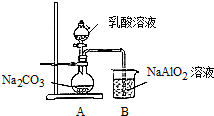
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
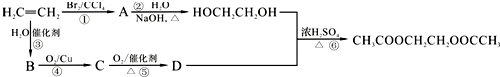
 )是一种有机合成中间体,A的合成路线如图所示,其中B~I分别代表一种有机物.
)是一种有机合成中间体,A的合成路线如图所示,其中B~I分别代表一种有机物.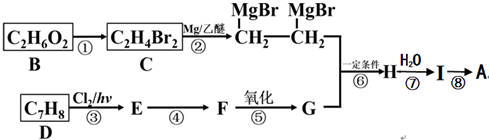
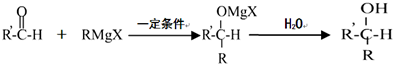
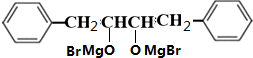 ;
;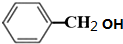 +O2$→_{△}^{铜}$2H2O+2
+O2$→_{△}^{铜}$2H2O+2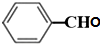 ;
;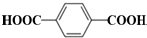 在催化剂的作用下生成聚合物--涤纶,写出涤纶的
在催化剂的作用下生成聚合物--涤纶,写出涤纶的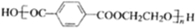 ;
; (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | CH3COOH═CH3COO-+H+ | ||
| C. | AgCl═Ag++Cl- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com