
. |
| M |
| m |
| n |
| 72g |
| 18g/mol |
| 134.4L |
| 22.4L/mol |
| 16g/mol×1mol+2g/mol×2mol+28g/mol×3mol |
| 6mol |


科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、15.7g混合物未与盐酸完全反应 |
| D、盐酸的物质的量浓度为3.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
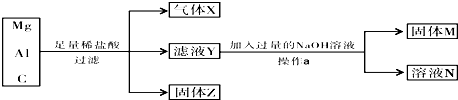
查看答案和解析>>
科目:高中化学 来源: 题型:
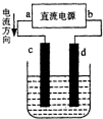 如图是电解饱和食盐水的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解饱和食盐水的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、b为正极 |
| B、c为阳极、d为阴极 |
| C、c的电极反应式:2H++2e→H2↑ |
| D、电解过程中,d极的质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ |
| B、电解水时为增强导电性可以加入少量的CuCl2固体 |
| C、电解精炼粗铜时,金、银等活泼性较弱的金属在阳极沉积成阳极泥 |
| D、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com