
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 在一个容积为 V L 的密闭容器中,放入 2L M(g)和 1L N(g),在一定条件下发生下列反 应:3M(g)+2N(g)?aP(g)+2Q(g).达到平衡后,容器中的压强增大 10%,气体压强之比等于气体物质的量之比,反应后气体物质的量增加.
解答 解:在一个容积为 V L 的密闭容器中,放入 2L M(g)和 1L N(g),在一定条件下发生下列反 应:3M(g)+2N(g)?aP(g)+2Q(g).达到平衡后,容器中的压强增大 10%,气体压强之比等于气体物质的量之比,反应后气体物质的量增加,3+2<a+2,得到a>3,故选D.
点评 本题考查了化学平衡建立的过程分析,气体压强之比等于气体物质的量之比,反应后气体物质的量增加,掌握基础是解题关键,题目难度中等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
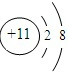 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有较强酸性和还原性 | 易溶于水,难溶于乙醇 |
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应C(s)+CO2(g)?2CO(g)△H=a kJ/mol不能自发进行,则该反应的a<0 | |
| B. | 已知中和热△H为-57.3kJ/mol,则稀醋酸与0.1 mol/L NaOH溶液反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热△H为-241.8 kJ/mol | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成17.6g硫化亚铁时,放出19.12kJ热量.该反应的热化学方程式可表示为Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 氢气的标准燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 现象①③说明物质燃烧需要达到一定的温度 | |
| B. | 现象②③说明物质燃烧需要氧气 | |
| C. | 现象①②说明白磷的着火点比红磷的着火点低 | |
| D. | 现象②说明红磷不是可燃物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 空硬质玻璃管 | 硬质玻璃管+氧化铜 | 硬质玻璃管+铜 | |
| 质量(g) | w | m | n |
| A. | $\frac{16m}{m-n}$ | B. | $\frac{16(w-n)}{m-n}$ | C. | $\frac{16n}{m-n}$ | D. | $\frac{16(n-w)}{m-n}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据组成原电池的条件,设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式.
根据组成原电池的条件,设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com