
| 实验操作 | 预期现象 | 结 论 | |
| 操作1: | 假设1或假设3成立 | ||
| 操作2: | 假设1成立 | ||
| 假设3成立 | |||
| 操作3: | 假设2或假设3成立 | ||
| 操作4 | 假设2成立 | ||
| 假设3成立 |
| 实验操作 | 预期现象 | 结论 | |
| 操作1: | 取红色粉末少许于试管中,加入足量(1分)3 mol?L-1H2SO4,和20%KSCN | 溶液呈血红色 | |
| 操作2: | 继续向试管中放入足量铁钉 | 铁钉上无红色固体析出 | |
| 铁钉上有红色固体析出 | |||
| 操作3: | 取红色粉末少许于试管中,加入足量3 mol?L-1H2SO4 | 红色粉末不能完全溶解(或溶液显蓝色) | |
| 操作4 | 取上层清液,逐滴加入到盛有0.01 mol?L-1KMnO4溶液的试管中 | KMnO4溶液不褪色 | |
| KMnO4溶液褪色 |


科目:高中化学 来源: 题型:阅读理解
 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 常温 |
| 常温 |

| 5 |
| 11 |
| 5 |
| 11 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省广元市高三第二次诊断性考试理综化学试卷(解析版) 题型:实验题
三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由 .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg ,则混合物中Cu2O的质量分数为
。
,则混合物中Cu2O的质量分数为
。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
|
物 质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择: A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
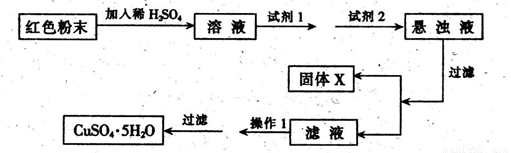
试回答:①试剂1为___ _,试剂2为 (填字母)。
②固体X的化学式为____,③操作I为_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com