
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种烈化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
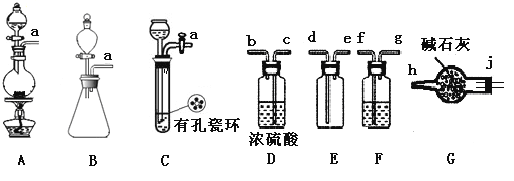
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
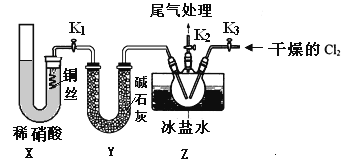
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
【答案】 A或B MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O fgcbdejh 饱和食盐水 排除装置内空气的干扰;可以随开随用,随关随停 K3 排尽三颈烧瓶中的空气防止NO和NOCl变质 2NOCl+H2O=2HCl+NO↑+NO2↑ 14.7375c/m×100%或写成
Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O fgcbdejh 饱和食盐水 排除装置内空气的干扰;可以随开随用,随关随停 K3 排尽三颈烧瓶中的空气防止NO和NOCl变质 2NOCl+H2O=2HCl+NO↑+NO2↑ 14.7375c/m×100%或写成![]() ×100%
×100%
【解析】(1)实验室制备Cl2可以用二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,或者用高锰酸钾固体与浓盐酸混合反应生成氯化钾、氯化锰、氯气和水,则发生装置可选择图中的A或B,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;正确答案:A或B ;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;正确答案:A或B ;MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O。
Mn2++Cl2↑+2H2O或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O。
(2)制得的氯气中含有氯化氢及水蒸气,所以需要利用饱和食盐水除去氯化氢后再用浓硫酸进行干燥,然后再根据氯气的密度比空气大的性质,用向上排空气法收集,氯气是大气污染物,需要进行尾气处理,可以用碱石灰做吸收剂,故装置连接顺序为: a→fgcbdejh,F装置内其盛装饱和食盐水,除去氯化氢气体;正确答案:fgcbdejh;饱和食盐水。
(3)①实验室也可用B装置制备NO,图X装置的优点为排除装置内空气的干扰;可以随开随用,随关随停;正确答案:排除装置内空气的干扰;可以随开随用,随关随停。
②检验装置气密性并装入药品,打开k2,然后再打开k3,通入一段时间气体,其目的是为排净三颈烧瓶中的空气,防止一氧化氮和NOCl变质;正确答案:K3;排尽三颈烧瓶中的空气防止NO和NOCl变质。
③NOCl与水反应生成盐酸、一氧化氮和二氧化氮,反应的化学方程式为:2NOCl+H2O=2HCl+NO↑+NO2↑;正确答案:2NOCl+H2O=2HCl+NO↑+NO2↑。
(4)取Z中所得液体mg溶于水,取25.00mL溶液中存在:n(NOCl)=n(Cl-)=n(Ag+)=c×22.50×10-3=0.0225cmol, 则250mL溶液中,n(NOCl)=0.225c mol,所以亚硝酰氯(NOC1)的质量分数为0.225c×65.5/m×100%=14.7375c/m×100%;正确答案:14.7375c/m×100%或写成[c×22.5×10-3×10×65.5]/m×100%。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.10molL-1NaOH溶液分别滴定20.00mL0.10molL-1的HX和HY溶液,滴定曲线如图所示。下列说法正确的是( )
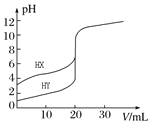
A.pH=7时,滴定HX消耗NaOH溶液体积等于20.00mL
B.将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH(HX)
C.当NaOH溶液体积为20.00mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-)
D.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学。
(1)普通玻璃是常见的硅酸盐产品,其主要成分的化学式为Na2CaSi6O14,以氧化物形式可表示为______。
(2)缺铁性贫血患者补充的铁,通常为硫酸亚铁的形式,而硫酸铁则没有这种药效.当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是______.若在酸性的硫酸亚铁溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式______.检验棕黄色溶液是否有Fe2+,可选用的试剂为______(填字母)。
A.稀硝酸B.浓硫酸C.KSCN溶液D.酸性高锰酸钾溶液
(3)从降低成本和减少环境污染的角度考虑,制取硫酸铜最好的方法是______(填字母)。
A.铜和浓硫酸反应B.铜和稀硫酸反应
C.氧化铜和硫酸反应D.铜与Fe2(SO4)3溶液反应
(4)实验室用硫酸铜晶体配制一定物质的量浓度的硫酸铜溶液,下列操作将使所配溶液物质的量浓度偏高的是______(填字母)。
A.所用的硫酸铜晶体已经部分风化失水
B.移液时不小心溅出少许溶液
C.容量瓶查漏后未经干燥就直接使用
D.定容时俯视容量瓶刻度线
E.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入![]() 的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、
的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、![]() 共存体系(不考虑氯气和水的反应)。下列说法正确的是
共存体系(不考虑氯气和水的反应)。下列说法正确的是
A.若反应中转移的电子为n mol,则![]()
B.溶液中![]() 可能为
可能为![]()
C.与NaOH反应的氯气物质的量:![]()
D.当溶液中![]() 时,反应的离子方程式为:
时,反应的离子方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将![]() 通入含
通入含![]() 的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、
的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、![]() 。温度不同,三者的量也不同。下列说法不正确的是
。温度不同,三者的量也不同。下列说法不正确的是
A.改变温度,当产物中![]() 的物质的量最大时,发生的离子反应为:
的物质的量最大时,发生的离子反应为:![]()
B.某温度下,反应后若溶液中![]() ,发生的离子反应为:
,发生的离子反应为:![]()
C.参加反应的![]() 与NaOH的物质的量关系一定是
与NaOH的物质的量关系一定是![]()
D.改变温度,反应中转移电子的物质的量可能为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对消除环境污染有重要意义。
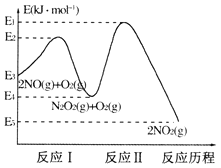
(1)NO在空气中存在如下反应:2NO(g)+O2(g)=2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:
回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)=2NO2(g)反应速率的是 _______(填“反应I”或“反应II”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及l0 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及l0 min和20 min各物质平衡浓度如表所示:
浓度/mol/L 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.040 | 0.030 | 0.030 |
20 | 0.032 | 0.034 | 0.017 |
①T℃时,该反应的平衡常数为 ________ (保留两位有效数字)。
②在l0 min时,若只改变某一条件使平衡发生移动,20 min时重新达到平衡,则改变的条件是________
③在20 min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
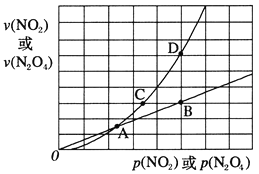
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在上图标出点中,指出能表示反应达到平衡状态的点是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的密闭容器中发生如下反应:2M(g)+N(g)![]() 2E(g)。若开始时只充入2 mol E(g),达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 mol N(g) 的混合气体,则达到化学平衡时M的转化率是
2E(g)。若开始时只充入2 mol E(g),达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 mol N(g) 的混合气体,则达到化学平衡时M的转化率是
A. 20% B. 40%
C. 80% D. 60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1molX、0.3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间的变化如图甲所示。图乙为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
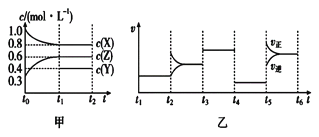
A. Y的起始物质的量为0.5mol
B. 该反应的化学方程式为2X(g)+Y(g)![]() 3Z(g) ΔH<0
3Z(g) ΔH<0
C. 若t0 =0,t1=10s,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·L-1·s-1
D. 反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为: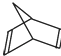
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com