
(19分)钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:

请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层) VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
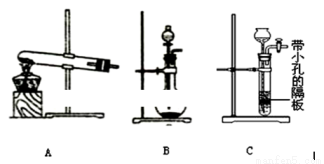
| 实验装置 | 实验药品 | 制备原理 |
甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
乙小组 | ② | 浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
(1)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率(2分);H2SO4(2分)
(2)ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+(3分)
(3)氨气(或氨水)(1分);有机萃取剂(1分)
(4) 氢氧化钠溶液(1分) 过滤、洗涤、干燥(2分)
(5)① 2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。(2分) ② B (2分)
CaCl2+2H2O+2NH3↑。(2分) ② B (2分)
③氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。 (3分)
【解析】
试题分析:(1)根据题意知,步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层) VOM2(有机层) + H2SO4 (水层) ,萃取过程该平衡正向移动,反萃取过程该平衡逆向移动;步骤②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率。步骤③中X试剂为H2SO4。(2)根据题给流程图知,步骤④为ClO3-将6VO2+氧化为VO3-,根据氧化还原方程式及离子方程式的书写原则写出该反应的离子方程式为ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+。(3)由题给工艺流程知,可以循环利用的物质有氨气(或氨水)和有机萃取剂。(4)操作Ⅰ为溶解操作,二氧化硅和氧化铜不溶于水,得到的废渣为二氧化硅和氧化铜的混合物,二氧化硅为酸性氧化物,氧化铜为碱性氧化物,故用氢氧化钠溶液溶解,充分反应后,过滤、洗涤、干燥,称量得到mg氧化铜。(5)甲小组为氢氧化钙和氯化铵固体共热生成氯化钙、氨气和水,化学方程式为2NH4Cl+Ca(OH)2
VOM2(有机层) + H2SO4 (水层) ,萃取过程该平衡正向移动,反萃取过程该平衡逆向移动;步骤②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率。步骤③中X试剂为H2SO4。(2)根据题给流程图知,步骤④为ClO3-将6VO2+氧化为VO3-,根据氧化还原方程式及离子方程式的书写原则写出该反应的离子方程式为ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+。(3)由题给工艺流程知,可以循环利用的物质有氨气(或氨水)和有机萃取剂。(4)操作Ⅰ为溶解操作,二氧化硅和氧化铜不溶于水,得到的废渣为二氧化硅和氧化铜的混合物,二氧化硅为酸性氧化物,氧化铜为碱性氧化物,故用氢氧化钠溶液溶解,充分反应后,过滤、洗涤、干燥,称量得到mg氧化铜。(5)甲小组为氢氧化钙和氯化铵固体共热生成氯化钙、氨气和水,化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑;乙小组用浓氨水和氢氧化钠固体不加热制氨气,应选B装置;产生氨气的原因为氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。
CaCl2+2H2O+2NH3↑;乙小组用浓氨水和氢氧化钠固体不加热制氨气,应选B装置;产生氨气的原因为氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。
考点:以工业上将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程为载体考查化学平衡移动原理、物质的分离和提纯、氨气的制备及相关反应方程式的书写。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:实验题
( 11分)乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3 溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH 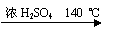 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)
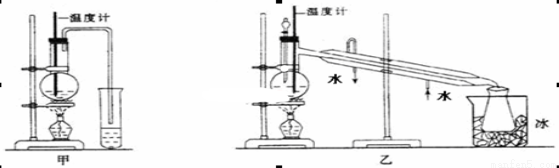
(1)甲图和乙图是两套实验室制乙醚的装置,选装置_______(填“甲”或“乙”)最合理,理由是_____________。
(2)反应液中应加入沸石,其作用是____________。
(3)反应中温度计的正确位置是水银球置于________________________。
(4)用上述装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是________________________________。
(5)如果温度太高(如170℃),将会发生一个有机副反应,反应方程式为:____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:填空题
(15分)白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。DBP是塑化剂的一种,可由下列路线合成:

已知以下信息:
①
②
(-R1、-R2表示氢原子或烃基)
(1)A的结构简式 ,D的结构简式是 ,D→E的反应类型 。
(2)D和H2 1︰1反应生成E,则E官能团名称为_________,DBP的分子式为 .
(3)由B和E以物质的量比1︰2合成DBP的化学方程式: 。
(4)写出同时符合下列条件的B的所有同分异构体结构简式 。
①能和NaHCO3溶液反应生成CO2 ③能使FeC13溶液发生显色反应
②能发生银镜反应 ④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的方程式 。
写出C生成D的反应的方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:填空题
(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵图中所示滤液中含钒的主要成分为 (写化学式)。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。

⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为□VO2++□H2C2O4+□_____ =□VO2++□CO2↑+□H2O。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ 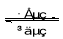 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.在少量Mg(OH)2悬浊液中滴加氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3·H2O+Mg2+
B.双氧水中滴加2滴FeCl3溶液:Fe3++H2O2=Fe2++O2↑+2H+
C.双氧水加入稀硫酸和KI溶液: H2O2+2H++2I—= I2+ O2↑+2 H2O
D.向银氨溶液中加入盐酸:[Ag(NH3)2]++OH﹣+3H+=Ag++2NH4++H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
25℃时,已知弱酸的电离常数:K(CH3COOH) = 1.8 ×10-5;K1(H2CO3) = 4.4 ×10-7;K2(H2CO3) = 4.7 × 10-11;K(HClO) = 4.0 ×10-8。则下列说法正确的是
A.新制氯水与碳酸氢钠不反应
B.25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者
C.NaClO溶液中通入少量二氧化碳的反应为:2NaClO+CO2+ H2O = Na2CO3 +2HClO
D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH
pH(Na2CO3)>pH(NaClO)>pH(CH3COONa)
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省烟台市高三5月适应性测试一理综化学试卷(解析版) 题型:填空题
(12分)【化学——化学与技术】
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)多级闪蒸法是目前“海水淡化”的主要技术。该法是在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水。由此可判断多级闪蒸法是 (填“物理变化” 或“化学变化”)。
(2)利用海水晒盐的原理是 ;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于 。
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品。在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代。

①写出两电极的反应式:阳极 ,阴极 。
②石棉隔膜的作用是 。离子交换膜电解槽中⑥、⑦分别是 、 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中:

B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:
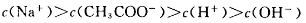
C.1.0mol Na2CO3 溶液中:
Na2CO3 溶液中:
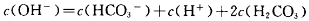
D.某二元弱酸的酸式盐NaHA溶液中:
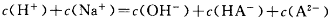
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高一化学试卷(解析版) 题型:选择题
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1 mol H2中的化学键消耗
的能量为Q1kJ,断裂1 mol Cl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学
键释放的能量为Q3 kJ。下列关系式中一定正确的是
A.Q1+Q2<Q3 B.Q1+Q2>2Q3
C.Q1+Q2=2Q3D.Q1+Q2<2Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com