
下列事实、离子方程式及其对应关系均正确的是
A.铁溶于稀硝酸,溶液变为浅绿色:Fe + 4H+ + NO3— = Fe3+ + NO ↑ + 2H2O
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-(橙色) + H2O  2CrO42-(黄色) +2H+
2CrO42-(黄色) +2H+
C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H+ + 4I- + O2 =2I2 + 2H2O
D.向水杨酸(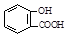 )中滴加NaHCO3溶液,放出无色气体:
)中滴加NaHCO3溶液,放出无色气体: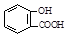 + 2HCO3- →
+ 2HCO3- →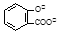 + 2CO2↑ + 2H2O
+ 2CO2↑ + 2H2O
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省高三下学期第一次月考化学试卷(解析版) 题型:选择题
下列事实、离子方程式及其对应关系均正确的是:
A.铁溶于稀硝酸,溶液变为浅绿色:Fe + 4H+ + NO3— = Fe3+ + NO ↑ + 2H2O
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色: Cr2O72-(橙色) + H2O  2CrO42-(黄色) +2H+
2CrO42-(黄色) +2H+
C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H+ + 4I- + O2 =2I2 + 2H2O
D.向水杨酸(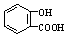 )中滴加NaHCO3溶液,放出无色气体:
)中滴加NaHCO3溶液,放出无色气体: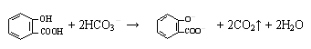
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com