
【题目】4-氨基-3硝基苯甲醚是合成类风湿关节炎治疗药物艾拉莫德的主要原料。4-氨基-3-硝基苯甲醚的合成路线如下:
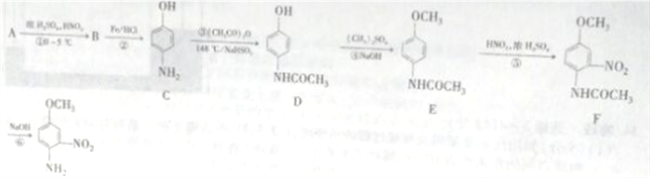
已知: NH2(有弱碱性,易被氧化)
NH2(有弱碱性,易被氧化)
回答下列问题:
(1)A的结构简式为_______________,B的名称是_______________。
(2)反应②的反应类型是____________。
(3)C中官能团的名称是_________________。
(4)写出反应③的化学方程式:________________,反应③温度较高,若不加NaHSO3会导致反应混合体系的颜色明显不同,可能的原因是________________。
(5)写出反应⑥的化学方程式:______________________。
(6)H是E的同分异构体,则满足下列条件的结构有____种(不考虑立体异构),其中核磁共振氢谱中有4组峰,且峰面积比为1:2:2:6的结构简式为_____________。
①含有 结构且能发生银镜反应
结构且能发生银镜反应
②N原子直接与苯环相连,且结构中不存在N—O键;
③苯环上有两个取代基。
【答案】 ![]() 对硝基苯酚 还原反应 (酚)烃基、氨基
对硝基苯酚 还原反应 (酚)烃基、氨基 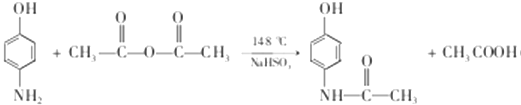 酚易被空气中的氧气氧化,加入NaHSO3可防止酚氧化
酚易被空气中的氧气氧化,加入NaHSO3可防止酚氧化 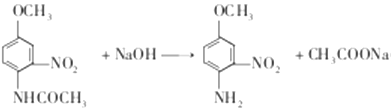 18
18 
【解析】本题考查有机物推断,从官能团的性质入手,(1)A→B,条件是浓硫酸和浓硝酸,A生成B发生硝化反应,根据C的结构简式,溴原子引入到羟基对位,则A的结构简式为:![]() ,B的结构简式为:
,B的结构简式为:![]() ,名称为对硝基苯酚;(2)反应B和C的结构简式对比,发生还原反应;(3)根据C的结构简式,含有官能团是氨基、羟基;(4)根据C和D的结构简式,CH3CO-取代-NH2上一个氢原子,反应方程式为:
,名称为对硝基苯酚;(2)反应B和C的结构简式对比,发生还原反应;(3)根据C的结构简式,含有官能团是氨基、羟基;(4)根据C和D的结构简式,CH3CO-取代-NH2上一个氢原子,反应方程式为: ,酚羟基容易被氧气氧化,因此温度较高,不加NaHSO3,造成酚易被空气中的氧气氧化,加入NaHSO3可防止酚氧化;(5) 根据F和G的结构简式,反应方程式为:
,酚羟基容易被氧气氧化,因此温度较高,不加NaHSO3,造成酚易被空气中的氧气氧化,加入NaHSO3可防止酚氧化;(5) 根据F和G的结构简式,反应方程式为: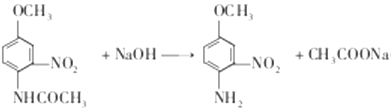 ;(6)属于甲酸某酯,
;(6)属于甲酸某酯,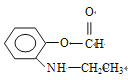 (邻、间、对三种)、
(邻、间、对三种)、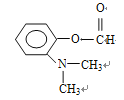 (邻、间、对三种)、
(邻、间、对三种)、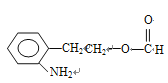 (邻、间、对三种)、
(邻、间、对三种)、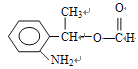 (邻、间、对三种)、
(邻、间、对三种)、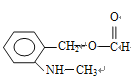 (邻、间、对三种),共有3×5=15种,符合信息的结构简式
(邻、间、对三种),共有3×5=15种,符合信息的结构简式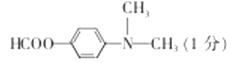 。
。


科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1) 写出甲醚燃烧的热化学方程式___________________ ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应:4C(s)+ 6H2(g)+ O2(g) = 2CH3OCH3(g)的反应热为___________
(2) 工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是___________(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”)
(3) 以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式___ _ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是________,B元素是___________,C元素是__________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其结构式是__________________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________________。
(4)F是由两种元素组成的三原子分子______,其电子式是________________。
(5)G分子中含有4个原子,它易溶于水的原因是________________
(6)A+与C2-形成的化合物水溶液呈_____性,其原因是(用离子方程式表示)___________,该水溶液中离子浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.沸点:CH4>NH3>H2O
B.得电子能力:C>N>O
C.酸性:H2SO4>HClO4>H3PO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种带有多孔结构的镍铝合金对H2具有较强的吸附性,其高催化活性和热稳定性使得该镍铝合金被用于很多工业过程中和有机合成反应中。下图是以镍黄铁矿(主要成分为NiS、FeS等)为原料制备该镍铝合金的工艺流程图:

回答下列问题:
(1)Ni(CO)4中C、O化合价与CO中的C、O化合价相同,则Ni化合价为_______价。
(2)在空气中“煅烧”生成Ni2O3和Fe2O3,写出Fe2O3的化学方程式________________。
(3)操作“镍![]() Ni(CO)4
Ni(CO)4![]() 镍”的目的是__________。
镍”的目的是__________。
(4) Ni、Al高温熔融时,气体x的作用是___________。对“高温熔融”物冷却后,需要进行粉碎处理,粉碎处理的目的是________________。
(5)“碱浸”可以使镍产生多孔结构,从而增强对H2的吸附性,“浸出液”中的主要离子是_____________;“浸出液”中的铝元素可循环利用,写出回收“浸出液”中的铝元素,并制备“高温熔融”时的原料Al的流程:_____________(示例:CuO![]() Cu2+
Cu2+![]() Cu)。
Cu)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。
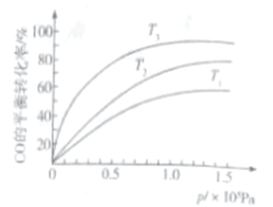
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G(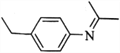 )有广泛应用。合成G的一种路径如图。1H-NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应。D的组成为C8H10。
)有广泛应用。合成G的一种路径如图。1H-NMR谱显示C结构中只有一种环境的氢,且不能发生银镜反应。D的组成为C8H10。
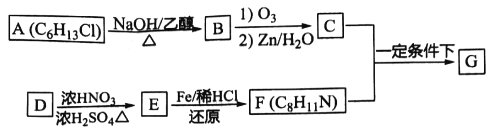
已知①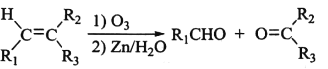
②
(1)由A生成B的化学方程式为____________________。
(2)C的结构简式为____________________。
(3)由D生成E的化学方程式为_____________。
(4)写出同时符合下列条件的F的所有同分异构体的结构简式_________。
①1H-NMR谱显示分子中含有苯环;
②核磁共振氢谱为4组峰,且面积比为6:2:2:1
(5)设计由苯及2-丙醇合成N-异丙基苯胺(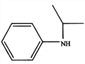 )的合成路线(流程图表示,无机试剂任选)__________________。
)的合成路线(流程图表示,无机试剂任选)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、1.01×105Pa下,将33gCO2通入到1000ml1.0mol·L-1的NaOH溶液中充分反应,放出xkJ热量。在该条件下1molCO2通入到2L1.0mol·L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为
A. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(2y-x)kJmol-1
B. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(4x-y)kJmol-1
C. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-1/2(4x-y)kJmol-1
D. CO2(g)+NaOH(aq)=NaHCO3(aq) △H=-(8x-2y)kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com