
【题目】H·C·Brown和Schlesinger于1942年在芝加哥大学发现的硼氢化钠(NaBH4)是最常用的还原剂之一,反应常生成偏硼酸钠(NaBO2)。有关实验流程如图所示:
![]()
I.氢化钠的制备:
已知NaH能在潮湿的空气中自燃。甲同学用如图所示装置(每种装置只选一次)来制取NaH。
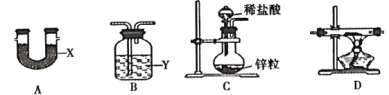
(1)装置的连接顺序是C→____________→D→__________,X、Y分别是__________、__________。
(2)通入H2,点燃装置D处酒精灯之前的实验操作是__________。若省略该操作,可能导致的后果是__________。
Ⅱ.硼氢化钠的制备及纯度测定:
将硼硅酸钠与氢化钠在450~500℃温度和(3.04~5.07)×105Pa压力下反应,生成硼氢化钠和硅酸钠。
(3)乙同学欲通过测定硼氢化钠与稀硫酸反应生成氢气的体积来确定硼氢化钠样品的纯度(杂质只有氢化钠),设计了以下4种装置,从易操作性、准确性角度考虑,宜选装置。__________
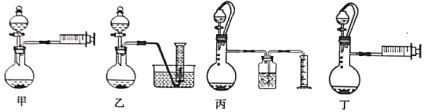
(4)称取4.04g样品(杂质只有氢化钠),重复实验操作三次,测得生成气体的平均体积为9.184L(已折算为标准状况),则样品中硼氢化钠的纯度为__________%(结果保留两位有效数字)。
Ⅲ.碉氢化钠的性质检验:
(5)碱性条件下,丙同学将NaBH4与CuSO4溶液反应可得到纳米铜和NaBO2,其离子方程式为__________。
【答案】A B 碱石灰(或生石灰等) 浓硫酸 验纯(或将装置中空气排尽) 爆炸(或仪器炸裂等) 丁 94 BH4-+4Cu2++8OH-=4Cu↓+BO2-+6H2O
【解析】
I.C装置由锌粒与稀盐酸反应制取氢气,制得的氢气中混有HCl和水蒸气,先通过碱性干燥剂除去水蒸气和氯化氢气体,经过处理的氢气再进入D与钠反应,反应之前先将氢气验纯,NaH易与水蒸气反应生成氢气,故D装置需要隔离水,所以还需要在D装置之后连接一个干燥装置,据此分析;
Ⅱ.(3)硼氢化钠与稀硫酸反应生成氢气的体积,首先要保证分液漏斗内液体顺利流下,量筒的精确度较低,量取气体的体积准确度不高,据此分析解答;
(4)设样品中NaH的物质的量为x,NaBH4的物质的量为y,则有24x+38y=4.04g,样品与稀硫酸反应,反应方程式为:2NaH+H2SO4=2H2↑+Na2SO4、2NaBH4+H2SO4+6H2O=8H2↑+2H3BO3+Na2SO4,生成气体的平均体积为9.184L,气体为氢气,故生成的n(H2)=![]() =0.41mol,有x+4y=0.41,解得x、y,可得其纯度;
=0.41mol,有x+4y=0.41,解得x、y,可得其纯度;
Ⅲ.(5)硼氢化钠是一种强还原剂,碱性条件下,NaBH4与CuSO4溶液发生氧化还原反应生成铜、NaBO2和水,据此书写离子反应方程式。
I.(1)根据分析,C装置中制取的氢气需要除杂和干燥,即除去水蒸气和氯化氢气体,应选择碱石灰(或生石灰等)既可以吸收氯化氢也可以吸收水分,D装置制得的NaH能在潮湿的空气中自燃,还需要在D装置之后连接一个干燥装置,则实验装置的连接顺序为C→A→D→B,A的盛装的试剂X为碱石灰(或生石灰等),B中盛装的试剂Y为浓硫酸;
(2)通入H2,点燃装置D处酒精灯之前的实验操作是验纯(或将装置中空气排尽);若省略该操作,氢气中混有空气,可能导致的后果是爆炸(或仪器炸裂等);
Ⅱ.(3)由于量筒的精确度不高,不属于精密的测量仪器,则收集的气体的体积准确度较低,硼氢化钠与稀硫酸反应时要确保反应装置内外压强相同,能使分液漏斗内的反应液顺利流下,综上分析应选择装置丁;
(4)设样品中NaH的物质的量为x,NaBH4的物质的量为y,则有24x+38y=4.04g,样品与稀硫酸反应,反应方程式为:2NaH+H2SO4=2H2↑+Na2SO4、2NaBH4+H2SO4+6H2O=8H2↑+2H3BO3+Na2SO4,生成气体的平均体积为9.184L,气体为氢气,故生成的n(H2)=![]() =0.41mol,有x+4y=0.41,解得y=0.1mol,x=0.01mol,则样品中硼氢化钠的纯度为
=0.41mol,有x+4y=0.41,解得y=0.1mol,x=0.01mol,则样品中硼氢化钠的纯度为![]() ×100%≈94%;
×100%≈94%;
Ⅲ.(5)硼氢化钠是一种强还原剂,碱性条件下,NaBH4与CuSO4溶液发生氧化还原反应生成铜、NaBO2和水,其离子方程式为BH4-+4Cu2++8OH-=4Cu↓+BO2-+6H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯具有类似茉莉花香的气味,可以用甲苯和乙醇进行人工合成,其合成路线如图:
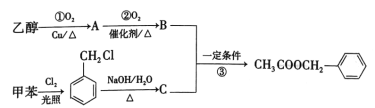
(1)写出反应①的化学方程式:___。
(2)反应③的反应类型为___。
(3)反应__(填序号)的原子利用率为100%,符合绿色化学的要求。
(4)C的结构简式为__,试写出C的另外两种不同类别的芳香类同分异构体的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于环丁烷羧酸(![]() )的叙述正确的是
)的叙述正确的是
A.烃基上的六氯代物为3种(不考虑立体异构)B.可以发生加聚、取代、中和反应
C.所有的碳原子在同一平面内D.与2-甲基环丙烷羧酸互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种如图所示的三室微生物燃料电池用来处理废水(废水中高浓度有机物用C6H12O6表示),下列叙述不正确的是

A.a电极反应式为:C6H12O6+6H2O-24e-=6CO2↑+24H+
B.b电极附近的溶液pH增大
C.温度越高,处理废水的效率越高
D.若反应中转移的电子数为NA,则生成标准状况下N2的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中橙色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O![]() 2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.
2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.
(1)向上述溶液中加入NaOH溶液,溶液呈 ______ 色
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈 ______ 色
(3)向原溶液中逐渐加入足量硝酸钡溶液![]() 已知BaCrO4为黄色沉淀
已知BaCrO4为黄色沉淀![]() ,则平衡 ______
,则平衡 ______ ![]() 填“向左移动”或“向右移动”
填“向左移动”或“向右移动”![]() ,溶液颜色将 ______ .
,溶液颜色将 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:

(1)定性如图甲可通过观察_________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______。
(2)定量用图乙所示装置做对照试验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对一些实验事实和理论解释正确的是
选项 | 实验事实 | 理论解释 |
A | HCl气体溶于水,能导电 | HCl为离子化合物 |
B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
C |
|
|
D | HF的沸点高于HCl | F的非金属性比Cl强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
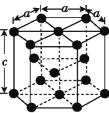
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co的价电子排布式为__,的I4(Co)__的I4(Fe)(填>、<或者=),原因是__。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中0.1molFe(CO)5含有配位键__个,写出2个与CO互为等电子体微粒__,图2中的σ键和π键个数之比是__(填元素符号)。
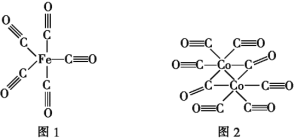
(3)金属钴的堆积方式为六方最密堆积,其配位数是__;该晶胞的边长为xnm,高为ynm,该晶胞的密度为__g·cm-3。(NA表示阿伏加德罗常数的值,列出代数式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com