
【题目】常温下,向100mL 0.01molL﹣1HA溶液中逐滴加入0.02molL﹣1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( ) 
A.HA为一元强酸
B.MOH为一元弱碱
C.N点水的电离程度大于K点水的电离程度
D.K点对应的溶液中:c(MOH)+c(OH﹣)﹣c(H+)=0.01 molL﹣1
【答案】D
【解析】解:A.0.01molL﹣1 HA溶液中pH=2,则HA是强酸,故A正确;
B.N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,故B正确;
C.N点溶液呈中性,K点溶液呈碱性,碱性溶液抑制水电离,所以N点水的电离程度大于K点水的电离程度,故C正确;
D.100mL 0.01molL﹣1HA溶液中逐滴加入0.02molL﹣1MOH溶液100mL,此时得到的是等浓度的MA和MOH,根据电荷守恒和物料守恒,得到c(A﹣)=c(MOH)+c(OH﹣)﹣c(H+)=0.005 molL﹣1,故D错误;
故选D.
0.01molL﹣1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒,电荷守恒,计算K点c(A﹣)=c(MOH)+c(OH﹣)﹣c(H+)的值.


科目:高中化学 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度的发挥原材料的价值,以下是工业生产纳米磁性氧化铁的流程,下列说法不正确的是

A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的铁锈
B. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+
C. 若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
D. 溶液A中Fe2+和Fe3+的浓度比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙两烧杯溶液中,分别含有大量Cu2+、K+、H+、Cl﹣、CO32﹣、OH﹣6种离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯溶液中大量存在的离子是
A. K+、OH﹣、CO32﹣ B. CO32﹣、OH﹣、Cl﹣
C. K+、H+、Cl﹣ D. Cu2+、H+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元酸H2A在水中存在以下电离:H2A═H++HA﹣ , HA﹣═H++A2﹣ , 回答下列问题:
(1)Na2A溶液呈性,理由是(用离子方程式表示).
(2)NaHA溶液呈性,理由是 .
(3)0.1mol/L的NaHA溶液的pH=3,则Ka(HA﹣)= .
(4)某温度下,向10mL 0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液V mL至溶液中水的离子积常数Ka=c2(OH﹣),此时溶液呈性,V10 (填“<”“>”或“=”)c(K+)/c(Na+)1(填“<”“>”或“=”),溶液中电荷守恒等式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素O、N可分别与H形成多种电子数为10的微粒,如H2O、H3O+、OH-、NH3、NH4+、NH2-等,下列有关说法正确的是
A. 原子或简单离子半径:N均大于O B. OH-和NH2-的质子数、中子数均相等
C. H3O+的电子式为![]() D. NH3和NH4+均能使湿润的红色石蕊试纸变蓝
D. NH3和NH4+均能使湿润的红色石蕊试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,导电能力最强的是
A.0.2mol/L硝酸钡溶液B.0.3mol/L氯化钠溶液
C.0.2mol/L硫酸铝溶液D.0.4mol/L碳酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列框图分析,下列说法正确的是( ) 
A.E2+的氧化性比M2+的氧化性强
B.在③反应中若不加稀硫酸可能看到红褐色沉淀
C.反应④的离子方程式可表示为:E3++3SCN﹣═E(SCN)3↓
D.在反应①中只用浓硫酸,既表现了酸性,又表现了氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]. 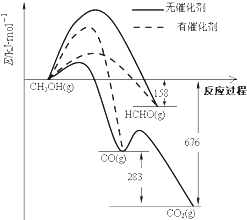
①在有催化剂作用下,CH3OH与O2反应主要生成(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H= .
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com