
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
分析 ①”烹胆矾则成铜“说明高温灼烧五水硫酸铜,五水硫酸铜会分解生成Cu;“熬胆矾铁釜亦化为铜”说明Fe和CuSO4反应生成Fe;
②取精铁煅之百余火,每煅称之,一煅一轻,至累煅二斤两不减,则纯钢也,说明生铁中C被氧化生成碳的氧化物而除掉.
解答 解:①”烹胆矾则成铜“说明高温灼烧五水硫酸铜,五水硫酸铜会分解生成Cu,该反应为分解反应;“熬胆矾铁釜亦化为铜”说明Fe和CuSO4反应生成Fe,该反应为置换反应;
②取精铁煅之百余火,每煅称之,一煅一轻,至累煅二斤两不减,则纯钢也,说明生铁中C被氧化生成碳的氧化物而除掉,该反应为化合反应,
通过以上分析知,不涉及的反应为复分解反应,故选D.
点评 本题考查基本反应类型判断,为基础题,明确基本反应类型区别是解本题关键,同时考查学生获取信息利用信息解答问题能力,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X.
将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L Br2通入足量NaOH溶液充分反应转移电子数为0.5NA | |
| B. | 60 g SiO2中所含Si-O键数为2NA | |
| C. | 常温常压下,5.6 g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA | |
| D. | 1 mol/L 13CH3OH溶液中溶质含有的中子数为15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )
常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )| A. | 忽略温度影响,滴入MOH溶液过程中,水的电离程度不变 | |
| B. | HA为弱酸,MOH为强碱 | |
| C. | N点MOH过量,故溶液中c(M+)>c(A-) | |
| D. | K点的c(MOH)+c(M+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
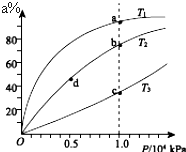 现有反应:mA+nB?ρC,在某温度下达到平衡状态.
现有反应:mA+nB?ρC,在某温度下达到平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O═SO42-+2Fe2++3H+ | |
| B. | NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| C. | NaHSO3溶液和稀HNO3反应:HSO3-+H+═SO2↑+H2O | |
| D. | NaHSO3溶液和NaAlO2溶液反应:HSO3-+AlO2-+H2O═SO32-+Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com