解答:
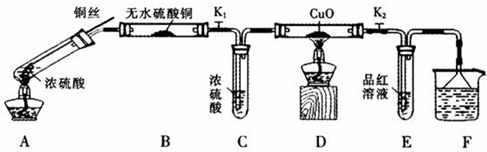
解:(1)A中的反应是浓硫酸和铜加热反应生成硫酸铜、二氧化硫和水,反应的化学方程Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O,
故答案为:Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O;
(2)装置中是铜和浓硫酸加热反应生成的气体中含有二氧化硫,二氧化硫是污染性的气体,不能排放到空气中,需要最后用氢氧化钠溶液或高锰酸钾溶液吸收,
故答案为:NaOH溶液(或KMnO
4溶液等);
(3)证明浓硫酸中硫元素的氧化性强于氢元素,利用元素化合价变化生成的产物分析判断,若生成氢气,D装置会黑色变化为红色,若生成二氧化硫E装置中品红会褪色,所以证明浓硫酸中硫元素的氧化性强于氢元素的实验现象是,D装置中氧化铜黑色不变化,说明无氢气生成,E装置中品红试液褪色说明生成了二氧化硫气体,
故答案为:D装置中黑色固体颜色无变化,E装置中溶液褪色;
(4)验证生成的溶液中含有铜离子,需要把试管中的液体倒入水中溶解,观察是否出现蓝色溶液,将A装置中冷却的混合溶液沿烧杯内壁缓缓倒入盛水的烧杯中,并不断搅拌,出现蓝色溶液证明含有铜离子,
故答案为:将A装置中冷却的混合溶液沿烧杯内壁缓缓倒入盛水的烧杯中,并不断搅拌;
(5)利用装置中铜不与浓硫酸接触反应,不放入铜丝反应,观察B装置是否变蓝,若不变蓝证明浓硫酸中的水不影响实验,若无水硫酸铜出现变蓝,说明浓硫酸中的水会影响实验,
故答案为:使用上述装置,不放入铜丝进行实验,观察无水硫酸铜是否变蓝;
(6)依据图表数据分析可知,浓度不同时出现黑色物质的时间随浓度增大减小,浓度为18mol/L时生成的黑色物质不能消失;
a.分析过程可知.发生的反应过程中生成二氧化硫和硫酸铜的反应过程中有奇谈反应发生生成黑色物质,铜与浓硫酸反应时所涉及的反应可能不止一个,故A符合;
b.图表数据分析可知硫酸浓度选择适当,可避免最后产物中出现黑色物质,故B符合;
c.浓硫酸和铜的反应浓度小于15mol/L也可能出现黑色物质,出现的时间长,该反应发生的条件不一定是硫酸浓度≥15mol?L
-1,故C不符合;
d.图表数据中,18mol/L的浓硫酸,出现褐色物质的时间短,黑色物质难以消失,所以硫酸浓度越大,黑色物质越快出现、越难消失,故d符合;
故答案为:abd;
(7)2Cu
2++4I
-=2CuI+I
2,2S
2O
32-+I
2=S
4O
62-+2I
-,分析反应可知,Cu
2+~I
2~22S
2O
32-,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L
-1Na
2S
2O
3溶液滴定生成的I
2,3次实验平均消耗该Na
2S
2O
3溶液V mL.若反应消耗铜的质量为ag,则生成硫酸铜的产率可以计算铜元素的产率即用铜元素物质的量计算产率,设25ml溶液中生成铜离子物质的量为x;
2Cu
2+~I
2~2S
2O
32-,
2 2
x b mol?L
-1×V×10
-3L
x=bV×10
-3mol
250ml溶液中铜离子物质的量=bV×10
-2mol;
硫酸铜的产率=
×100%=
%;
故答案为;
%.