
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气量相等的是( )
①C2H2与CH3CHO ②C7H8与C6H12 ③C2H2与C6H6 ④HCOOCH3与CH3COOH.
A.①②③④ B.①②④ C.①④ D.②④
【答案】B
【解析】
试题分析:①1molC2H2完全燃烧消耗氧气的物质的量为2+![]() =2.5;1molCH3CHO完全燃烧消耗氧气的物质的量为2+
=2.5;1molCH3CHO完全燃烧消耗氧气的物质的量为2+![]() ﹣
﹣![]() =2.5;二者相等,故说法正确;②1moC7H8完全燃烧消耗氧气的物质的量为7+
=2.5;二者相等,故说法正确;②1moC7H8完全燃烧消耗氧气的物质的量为7+![]() =9;与1molC6H12 完全燃烧消耗氧气的物质的量为6+
=9;与1molC6H12 完全燃烧消耗氧气的物质的量为6+![]() =9;二者相等,故说法正确;③1moC2H2完全燃烧消耗氧气的物质的量为2+
=9;二者相等,故说法正确;③1moC2H2完全燃烧消耗氧气的物质的量为2+![]() =2.5;与1molC6H6完全燃烧消耗氧气的物质的量为6+
=2.5;与1molC6H6完全燃烧消耗氧气的物质的量为6+![]() =7.5;二者不相等,故说法错误;④1moHCOOCH3完全燃烧消耗氧气的物质的量为2+
=7.5;二者不相等,故说法错误;④1moHCOOCH3完全燃烧消耗氧气的物质的量为2+![]() ﹣1=2;与1molCH3COOH完全燃烧消耗氧气的物质的量为2+
﹣1=2;与1molCH3COOH完全燃烧消耗氧气的物质的量为2+![]() ﹣1=2;二者相等,故说法正确;故选项B正确。
﹣1=2;二者相等,故说法正确;故选项B正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
物质 | 乙酸 | 正丁醇 | 乙酸丁酯 |
熔点/ ℃ | 16.6 | -89.5 | -73.5 |
沸点/ ℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
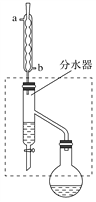
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)管口通入;通过分水器下端旋塞分出的生成物是________,其目的是_____________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________(填标号)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
②分液漏斗有两种,如下图。分液时应选择下图中________形分液漏斗,其原因是_____________________________________________。

③蒸馏操作时,需收集________ ℃的馏分,沸点大于140 ℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-),在常温下溶液中的pH+pOH=14,又已知正常人(人的体温高于室温)的血液pH=7.3,则正常人血液的pOH是( )
A. 大于6.7 B. 小于6.7
C. 等于6.7 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
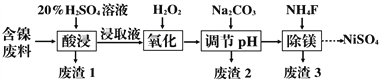
【题目】某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图:
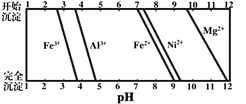
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图。
②25℃时,NH3·H2O的电离常数Kb=1.8×10-5。
HF的电离常数Ka=7.2×10-4,Ksp (MgF2)=7.4×10-11。
(1)加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是__________(填化学式)。
(2)Mg能与饱和NH4Cl溶液反应产生NH3,请用化学平衡移动原理解释(用必要的文
字和离子方程式回答)_______________________________________。
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=________ mol·L-1(列出计算式即可)。
NH4F溶液呈 _____(填“酸性”、“碱性”或“中性”)。
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol·L-1,当除镁率达到99%时,溶液中c(F-)=_______ mol·L-1。
(5)在NaOH溶液中用NaClO与NiSO4反应可得NiO(OH),化学方程式为________________________________;NiO(OH)与贮氢的镧镍合金可组成镍氢碱性电池(KOH溶液),工作原理为:LaNi5H6+6NiO(OH) ![]() LaNi5+6NiO+6H2O,负极的电极反应式:__________________________________。
LaNi5+6NiO+6H2O,负极的电极反应式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白[第(1)~(4)小题用元素符号填写]。
(1)第三周期原子半径最小的元素________。
(2)第一电离能最大的元素________。
(3)电负性最大的元素________。
(4)第四周期中第一电离能最小的元素________。
(5)含有8个质子,10个中子的原子的化学符号________。
(6)最外层电子排布为4s24p1的原子的核电荷数为________。
(7)周期表中最活泼的非金属元素原子的轨道表示式为___________________。
(8)某元素核外有三个电子层,最外层电子数是核外电子总数的![]() ,写出该元素原子的电子排布式是__________________。
,写出该元素原子的电子排布式是__________________。
(9)写出铜元素在周期表中的位置________________,它位于________区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 漂白粉和医用酒精均可用作消毒剂
B. 聚乙烯塑料用作食品包装材料,会造成环境污染
C. 防晒是为防止强紫外线引起皮肤蛋白质被灼伤变性
D. 硅胶、生石灰、还原铁粉,均可用于防止食品被氧化而变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 阳离子都只有氧化性
B. 分子晶体中一定存在分子间作用力
C. 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D. 分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com