
据图回答下列问题: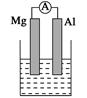
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是______________________
负极反应式为:_________________________________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为
______________________________________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是________(填序号)。
a.恒温、恒容条件下,混合气体的平均相对分子质量不变
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH
(2)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。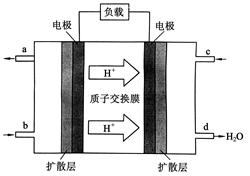
①该电池工作时,b口通入的物质为________________,
c口通入的物质为________________。
②该电池负极的电极反应式为:_______
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,
有______________NA个电子转移。
I(1)Mg逐渐溶解,Al片上有气泡冒出,指针偏转;Mg-2e-=Mg2+
(2)Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
II.
III.(1)d(2)①CH3OH;O2或空气②CH3OH-6e-+H2O=CO2+6H+ ③1.2
解析试题分析:Ⅰ、(1)若烧杯中溶液为稀硫酸,则镁为负极,观察到的现象是Mg逐渐溶解,Al片上有气泡冒出,指针偏转;负极反应式为Mg-2e-=Mg2+;(2)若烧杯中溶液为氢氧化钠溶液,则负极为Al,总反应化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Ⅱ、由Al、Cu、浓硝酸组成原电池,Al在浓硝酸中钝化,则Cu为负极,正极的电极反应式为 ;Ⅲ、(1)a.恒温、恒容条件下,混合气体的平均相对分子质量不变,说明各组分物质的量不再改变,反应达平衡;b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡;c.一定条件下,CO、H2和CH3OH的浓度保持不变,说明已经平衡;d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH,为同一个方向,不能说明是否平衡;故选d。(2)所给甲醇燃料电池工作时,b为负极通入的物质为CH3OH;c口通入的物质为O2或空气;负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+;工作一段时间后,当6.4 g甲醇完全反应生成CO2时,转移1.2mol电子,即有1.2NA个电子转移。
;Ⅲ、(1)a.恒温、恒容条件下,混合气体的平均相对分子质量不变,说明各组分物质的量不再改变,反应达平衡;b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡;c.一定条件下,CO、H2和CH3OH的浓度保持不变,说明已经平衡;d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH,为同一个方向,不能说明是否平衡;故选d。(2)所给甲醇燃料电池工作时,b为负极通入的物质为CH3OH;c口通入的物质为O2或空气;负极的电极反应式为CH3OH-6e-+H2O=CO2+6H+;工作一段时间后,当6.4 g甲醇完全反应生成CO2时,转移1.2mol电子,即有1.2NA个电子转移。
考点:考查原电池原理等相关知识。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:填空题
(10分) Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)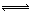 NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
2NO(g)+Cl2(g)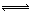 2ClNO(g) K2 ?H < 0 (II)
2ClNO(g) K2 ?H < 0 (II)
(1)4NO2(g)+2NaCl(s)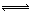 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:N2O4(g)  2NO2(g) ΔH="+57.20kJ" · mol-1
2NO2(g) ΔH="+57.20kJ" · mol-1
在100℃时,将0.100molN2O4气体充入1L恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4) /mol··L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2) /mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)将3 mol A和3 mol B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) 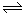 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
(1)B的平均反应速率为 。
(2)x的值为 。
(3)5 min后,A、B的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能自发进行的条件是 。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是 。
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3: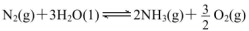
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=______,该反应中的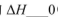 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。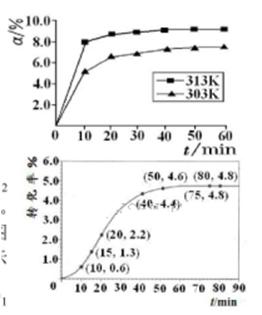
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(1)发生反应,N2转化率随时间(t)变化如图。15-20min内,v(NH3)=____。若其他条件不变,在图中画出使用催化剂后N2的转化率随反应时间变化的曲线示意图。
(2) 25℃时,某同学将0.lmol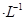 盐酸与0.2 mol
盐酸与0.2 mol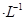 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中 (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数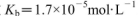 )
)
(3) 25℃时,向O.lmol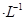 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol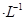 氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol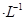 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,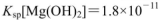 ,
,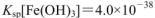 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)碳及其化合物有广泛的用途。
(1)在电化学中,常用碳作电极。在碱性锌锰干电池中,碳棒作 极。
(2)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)=CO(g)+H2(g);△H=+131.3kJ?mol-1,则要制备标准状况下22.4升水煤气,转移的电子的物质的量为 ,需要吸收的热量为 kJ。
(3)工业上把水煤气中的混合气体经过处理后,获得的较纯H2用于合成氨:
N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ?mol-1。下图1是在两种不同实验条件下模拟化工生产进行实验所测得N2随时间变化示意图。
2NH3(g);△H=-92.4kJ?mol-1。下图1是在两种不同实验条件下模拟化工生产进行实验所测得N2随时间变化示意图。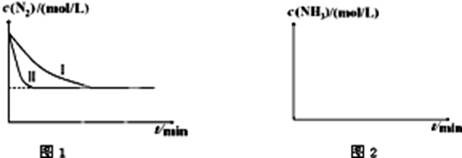
①与实验Ⅰ比较,实验Ⅱ改变的条件为: 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
(4)Na2CO3可在降低温室气体排放中用作CO2的捕捉剂。1L0.2mol/L Na2CO3溶液吸收标准状况下2.24LCO2后,溶液中各离子浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,甲、乙均为容积1L的恒容容器,丙为恒压容器。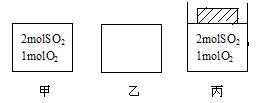
向甲、丙中分别充入相应气体,使丙起始体积为1L,维持500℃发生反应:2SO2+O2  2SO3至平衡。
2SO3至平衡。
甲中反应10min后达到平衡时,容器中SO3的体积分数为91%,则反应从开始至平衡的平均反应速率v(O2)= mol·L-1·min-1,平衡常数表达式为 。SO2的平衡转化率= 。丙中达到平衡所需的时间 10min(填“>”、“=”、“<”),SO3的体积分数 91%(填“>”、“=”、“<”)。若上述已达平衡的甲、丙容器中分别充入0.5molAr气体,容器中SO3的物质的量:甲 丙 (填“增大”、“不变”、“减小”)。
(2)若在乙容器中充入x molSO2 0.2molO2 ymolSO3维持500℃反应至平衡时,容器中SO3的体积分数亦为91%,则x= ,y= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com