
| A. | 苯(苯酚):滴入适量的氢氧化钠溶液,振荡,分液 | |
| B. | 苯酚钠(氯化钠):通入过量的CO2,过滤后在沉淀中加入烧碱溶液 | |
| C. | 乙酸乙酯(乙醇):加入适量饱和碳酸钠溶液,振荡,分液 | |
| D. | 硬脂酸钠(甘油\烧碱和水):加入食盐细粒充分搅拌,静置后过滤 |
分析 A.苯酚与NaOH溶液反应后,与苯分层;
B.苯酚钠与二氧化碳反应生成苯酚沉淀,过滤后苯酚与NaOH溶液反应,易引入新杂质NaOH;
C.乙醇易溶于水,乙酸乙酯与碳酸钠溶液分层;
D.加NaCl,降低高级脂肪酸钠的溶解度,发生盐析.
解答 解:A.苯酚与NaOH溶液反应后,与苯分层,然后分液可除杂,故A正确;
B.苯酚钠与二氧化碳反应生成苯酚沉淀,过滤后苯酚与NaOH溶液反应,易引入新杂质NaOH,不能除杂,故B错误;
C.乙醇易溶于水,乙酸乙酯与碳酸钠溶液分层,分液可分离,故C正确;
D.加NaCl,降低高级脂肪酸钠的溶解度,发生盐析,充分搅拌,静置后过滤可分离,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数≥4的金属元素有6种,元素符号分别是Ge Sn Pb Te Bi Po | |
| B. | 过渡元素全部属于副族元素,全部都是金属元素,它们位于周期表第3纵行至第12纵行 | |
| C. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为1或2 | |
| D. | 在元素周期表中位于ⅡB族左右两列元素分别是ⅠB和ⅢB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型: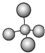 | |
| B. | $\underset{\stackrel{1}{\;}}{1}\underset{\stackrel{\;}{H}}{\;}$、$\underset{\stackrel{2}{\;}}{1}\underset{\stackrel{\;}{H}}{\;}$为同素异形体 | |
| C. | 离子结构示意图 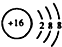 可以表示32S2-,又可以表示34S2- 可以表示32S2-,又可以表示34S2- | |
| D. | 中子数为146、质子数为92的铀(U)原子 14692U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成乙烯的是氢氧化钾的水溶液 | B. | 生成乙醇的是氢氧化钾的水溶液? | ||
| C. | 生成乙烯的是在170℃下进行的 | D. | 生成乙醇的是氢氧化钾的醇溶液? |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
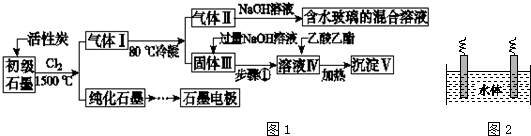
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
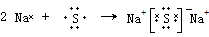 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH均为9的CH3COONa和NaOH溶液中,水的电离程度相同 | |
| B. | 室温下,0.1mol•L-1氨水加水稀释后,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| C. | 电解精炼铜过程中,阳极减少的质量与阴极增加的质量一定相等 | |
| D. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
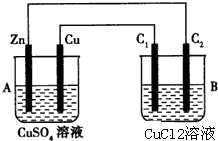 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com