
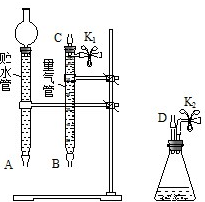
 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.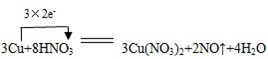 .
.| 实验编号 | 稀硝酸的浓度 /(mol/L) | 稀硝酸的体积 /mL | 温度 /℃ | 时间 /min | 收集气体的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
分析 (1)①根据铜与稀硝酸反应中,铜做还原剂被氧化,而稀硝酸中的氮元素被还原为NO,根据得失电子数守恒来计算;
②从所给的药品和仪器可知,本题可以探究硝酸浓度的不同或温度的不同对反应速率的影响;
③根据题意可知,此装置应为排水量气装置,而D为反应的发生装置,连接量气管将量气管中的水排出,即量气管起排水量气的作用,而贮水管起到贮水的作用,故橡胶软管的应D接C接B接A,据此分析;
④由于量气管起到收集NO的作用,故将锥形瓶到量气管间的空气排干净即可,据此分析;
(2)要设计实验探究浓度对化学反应速率的影响,则必须保持其他影响反应速率的影响因素一致,据此分析.
解答 解:(1)①因铜失去电子,HNO3得到电子,铜做还原剂被氧化,而稀硝酸中的氮元素被还原为NO,故化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;电子转移方向和数目用单线桥表示为: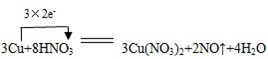 ,
,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;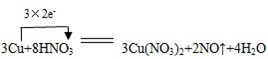 ;
;
②从所给的药品和仪器可知,本题可以探究硝酸浓度的不同或温度的不同对反应速率的影响,而要探究一个影响因素,则必须保持其他影响因素一致,故若探究硝酸浓度对反应速率的影响,则温度相同,反之,若温度不同,则硝酸浓度相同;测定反应速率的快慢,可以通过测定相同时间内产生气体体积或
产生相同体积的气体所需的时间来进行,
故答案为:相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度);相同时间内产生气体体积(或产生相同体积的气体所需的时间);
③根据题意可知,此装置应为排水量气装置,而D为反应的发生装置,生成的气体通过软管进入量气管,将其中的水排出,即量气管起排水量气的作用,排出的水进入贮水管,而贮水管起到贮水的作用,故橡胶软管的应D接C接B接A,故图为: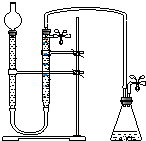 ,
,
故答案为: ;
;
④由于量气管起到收集NO的作用,故要将锥形瓶到量气管间的空气排干净,从从K2处的橡胶管向装置中通入CO2,松开K1弹簧夹,在K1处接盛有澄清石灰水的烧杯,直到石灰水变浑浊时为止,故答案为:松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止;
(2)要设计实验探究浓度对化学反应速率的影响,则必须保持其他影响反应速率的影响因素一致,故若②的稀硝酸的浓度为b,则应保持温度与①的相同即25℃,而由于稀硝酸的浓度不同,故反应速率不同,则在相同的时间段内,收集到的其他的体积要不同,即时间为t1,则收集到的气体体积应为V2;或收集相同体积的气体时,所需的时间不同,即收集到的气体体积也为V1,但所需时间为t2;
既然①②对比试验探究的是浓度的不同对反应速率的影响,则①③探究的是温度的不同对反应速率的影响,故③中温度应为50℃,则稀硝酸的浓度应为a,而由于温度不同,故反应速率不同,则在相同的时间段内,收集到的其他的体积要不同,即时间为t1,则收集到的气体体积应为V2;或收集相同体积的气体时,所需的时间不同,即收集到的气体体积也为V1,但所需时间为t2.故答案为:
| 实验 编号 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 /℃ | 时间 /min | 收集气体 的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | b | V | 25 | t1(或t2) | V2(或V1) |
| ③ | a(或b) | V | 50 | t2(或t1) | V1(或V2) |
点评 本题考查了影响反应速率的因素,应注意的是要探究某个因素对反应速率的影响,则必须保持其他影响因素一致,且可以通过测量在相同时间段内收集到的气体体积的大小或收集相同体积的气体所需的时间来判断反应速率的快慢.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室用大理石与盐酸制取CO2 | B. |  制取SO2、检验SO2的漂白性 | ||
| C. | 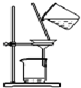 分离硫酸铜晶体 | D. | 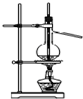 分离乙醇和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al能溶于氯化铵溶液中且放出氢气 | |
| B. | Al、Al2O3、Al(OH)3都可溶于盐酸和氢氧化钠溶液中 | |
| C. | Al(OH)3能和NaOH溶液反应,也能与氨水反应 | |
| D. | 向Al2(SO4)3溶液中滴加过量氨水,可得白色沉淀,加入过量NaHSO4溶液沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Mg2+、H+、K+ | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | Ag+、K+、Cl-、SO42一 | D. | MnO4-、NO3-、SO42-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com