

分析 流程分析:反应室①中发生反应 SO2+Br2+2H2O=H2SO4+2HBr,经操作Ⅰ蒸馏得硫酸和氢溴酸的粗品(含溴),反应室②中加入Na2SO3还原粗品中的Br2,但会反应生成SO42- 加入氢氧化钡后过滤得硫酸钡沉淀和无色溶液,再蒸馏得到纯品氢溴酸,
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr;Br2氧化SO2放出很多热量,Br2和HBr挥发;
(2)由工艺流程可知,操作Ⅰ为互溶的溶液组分的分离,应是蒸馏,根据蒸馏操作的方法判断使用的仪器;
(3)粗品中可能含有为反应的Br2,应除去Br2;
(4)根据盐酸易挥发、硝酸易分解进行分析;
(5)①用KSCN溶液检验Fe3+,滴加KSCN溶液,溶液变成血红色;
②由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验;
解答 解:流程分析:反应室①中发生反应 SO2+Br2+2H2O=H2SO4+2HBr,经操作Ⅰ蒸馏得硫酸和氢溴酸的粗品(含溴),反应室②中加入Na2SO3还原粗品中的Br2,但会反应生成SO42- 加入氢氧化钡后过滤得硫酸钡沉淀和无色溶液,再蒸馏得到纯品氢溴酸,
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr,反应的离子方程式为:SO2+Br2+2H2O=SO42-+2Br-+4H+;Br2氧化SO2放出很多热量,Br2和HBr易挥发,使用冰水,降低体系温度,防止Br2和HBr挥发,使反应完全,
故答案为:SO2+Br2+2H2O=SO42-+2Br-+4H+;防止Br2和HBr挥发;
(2)由工艺流程可知,操作Ⅰ为互溶的溶液组分的分离,应是蒸馏,蒸馏操作使用的仪器有:蒸馏烧瓶、温度计、冷凝管、接液管和锥形瓶,
故答案为:蒸馏,漏斗、玻璃棒、烧杯;
(3)粗品中可能含有为反应的Br2,加入Na2SO3,除去粗品中未反应完的溴,
故答案为:除去粗品中未反应完的溴;
(4)操作Ⅲ需要通过蒸馏获得氢溴酸,而盐酸、硝酸易挥发,硝酸易分解,会影响纯度,所以不能用BaCl2或者Ba(NO3)2溶液代替氢氧化钡,
故答案为:不能,盐酸、硝酸易挥发,硝酸易分解,影响纯度;
(5)①用KSCN溶液检验Fe3+,取少许溶液滴加KSCN溶液,溶液变成血红色,说明氢溴酸呈淡黄色是因为含Fe3+,
故答案为:取样,滴加KSCN溶液,若溶液变为红色,则证明含Fe3+;
②由工艺流程可知,溶液中可能含有Br2,证明该假设成立的方法:用胶头滴管取制得的氢溴酸于试管中,滴加CCl4、振荡、静止,下层呈橙红色,证明因含Br2而显黄色;
故答案为:Br2;取样,加入CCl4少许,充分震荡,若油层呈橙色(橙红色)证明含Br2.
点评 本题考查物质制备方案的设计与评价,题目难度中等,涉及物质的分离提纯等基本操作、离子检验、物质性质等知识,是对知识的综合运用,需学生具有扎实的基础知识与灵活运用知识解决问题的能力.


科目:高中化学 来源: 题型:填空题
 (8)CH2=CH-CH3(9)
(8)CH2=CH-CH3(9) (10)2,2-二甲基丁烷.
(10)2,2-二甲基丁烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
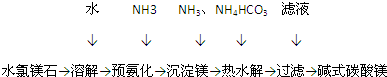
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
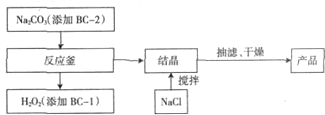
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
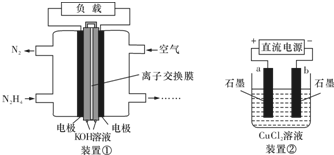
| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2↑+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4 | |
| C. | 该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnCl2[ZnSO4] | B. | NaOH[H2O] | C. | CuCl2[HCl] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com