
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①③④ |
分析 不用其他试剂通过互滴即可鉴别,先观察试剂的颜色,再利用试剂之间的反应现象不同鉴别,以此来解答.
解答 解:①NaOH与MgCl2、AlCl3反应均生成白色沉淀,且NaOH过量时氢氧化铝溶解,均与K2SO4不反应,可鉴别,故选;
②蓝色溶液为CuSO4,与CuSO4反应生成蓝色沉淀的为Ba(OH)2,剩余两种试剂中与Ba(OH)2反应生成白色沉淀的为Na2CO3,剩余一种为硫酸,可鉴别,故选;③NaAlO2与HNO3、NaHSO4的反应现象相同,不能鉴别,故不选;
④(NH4)2CO3与NaOH反应生成刺激性气体,(NH4)2CO3与BaCl2反应生成白色沉淀,BaCl2、MgSO4反应生成白色沉淀,可鉴别,故选;
故选C.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
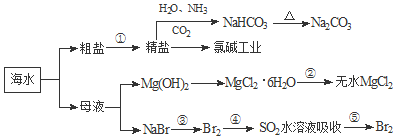
| A. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| B. | 工业生产上向母液中加石灰乳使Mg2+转化为Mg(OH)2沉淀 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与Cl2加成(1,2-二氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 氢气与苯催化剂加热的条件下发生的反应(环己烷) | |
| D. | 氯气与甲烷按照比例2:1在光照条件下反应(二氯甲烷) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
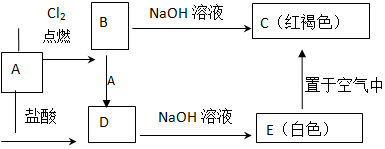
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、OH-、SO42- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | K+、H+、SO42-、Al3+ | D. | Na+、H+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com