
【题目】下列关于晶体的叙述错误的是
A.在金刚石网状结构中,由共价键形成的最小碳环上有6个碳原子
B.在氯化钠晶体中,每个钠离子的周围与它最近且等距离的钠离子有12个
C.在干冰晶体中,每个二氧化碳分子周围距离最近且相等的二氧化碳分子数是12
D.在氯化铯的晶体中,每个铯离子的周围与它最近且等距离的铯离子有8个
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知有机物A能发生以下转化,并且A可以作为水果的催熟剂,在一定条件下A可以发生自身加成反应,形成高分子化合物E.
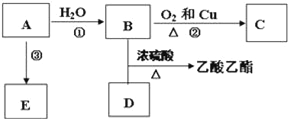
(1)写出E的结构简式______,E______(填“能”或“不能”)使酸性KMnO4溶液褪色.
(2)请写出C的名称是______,D分子中的官能团名称是______.
(3)请写出反应②以及B与D发生反应的化学方程式,并注明反应类型:
②______,反应类型______;
B+D______,反应类型______.
(4)若完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式______,并写出其所有可能的结构简式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列说法正确的是( )
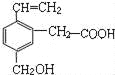
A. 该有机物的分子式为C11H15O3
B. 该有机物不能发生取代反应
C. 1 mol该物质与足量的钠反应可以生成1 mol氢气
D. 1 mol该有机物可以与1 mol碳酸钠发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)![]() SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
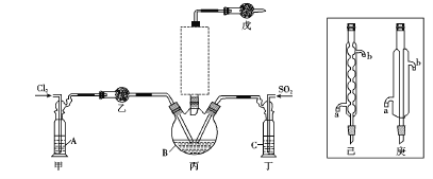
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为 ;溶液A为 。
②上图实框中仪器己的名称为 ;反应装置图的虚框中未画出的仪器是 (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是 。
④下列有关说法错误的是 (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为 %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期且相邻的元素,B基态原子2p轨道中有三个自旋方向完全相同的电子;C基态原子核外电子占有9个轨道,且只有1个未成对电子;D、E、F是位于同一周期的金属元素, D、E基态原子的价电子层中未成对电子数分别为4、2,且原子序数相差2;F是ds区元素,F基态原子的价电子层中只有1个未成对电子。
回答下列问题:
(1)E元素在周期表中的位置是____________,E的价层电子排布图为________________。E单质能导电的原因是_______________。
(2)A、B、D三种元素形成配合物D3[D(AB)6]2,该配合物的中心离子是___,1 个AB-离子中含有_____个 π键。
(3)A元素最高价氧化物分子中A原子的杂化轨道类型是______,BC3分子的立体构型是_____________。
(4)新制的F(OH)2能够溶解于浓NaOH溶液中形成一种配离子,反应的离子方程式是__。
(5)E、F元素的第二电离能分别是:IE=1753kJ/mol、IF=1958kJ/mol, IF>IE的原因是___。
(6)C、F元素形成的一种化合物晶胞如下图,F位于面心和顶点,其晶胞参数为a pm。
①已知M点的坐标为![]() ,则N点的坐标为______,P点的坐标为_______。
,则N点的坐标为______,P点的坐标为_______。
若阿伏加德罗常数用NA表示,则该晶体的密度是_____________g/cm3(只要求列算式)。
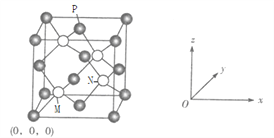
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是( )

A. a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. b电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极距(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的是____。
(2)对硝基氯苯、邻硝基氯苯、间硝基氯苯,三种分子的偶极矩由大到小的排列顺序是________。
(3)实验测得:μ(PF3)=1.03德拜;μ(BCl3)=0。由此可知,PF3分子是____构型,BCl3分子是____构型。
(4)冶癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体。棕黄色者μ>0,淡黄色者μ=0。试画出两种异形体的构型图。
构型图:淡黄色____________________,棕黄色____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(含有Cr2O3,FeO、Al2O3、SiO2等成分)为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O),其主要工艺流程如下:
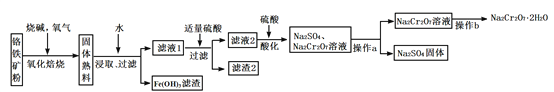
提示:熟料中含有Na2CrO4、NaFeO2等成分。
回答下列问题:
(1)将铬铁矿粉碎的目的是_____________________________ 。
(2)氧化焙烧时,生成Na2CrO4的化学方程式是__________。
(3)滤渣2中除Al(OH)3外还有__________(填化学式)。
(4)加入硫酸酸化的目的是__________________________。
(5)根据下图,请将操作a补充完整:________________,洗涤,干燥。
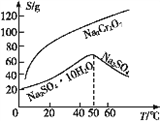
(6)控制105~110℃,向较浓的Na2Cr2O7溶液中加入KCl固体发生复分解反应,立即析出K2Cr2O7晶体。能生成K2Cr2O7晶体的原因是_____________。
(7)向Na2Cr2O7酸性溶液中加入过量FeSO4溶液,生成Cr3+和 Fe3+,再加入过量的强碱溶液生成铁铬氧体沉淀(CrxFe3-xO4)。加入过量强碱生成铁铬氧体沉淀的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com