
【题目】下面是元素周期表的简略框架图。
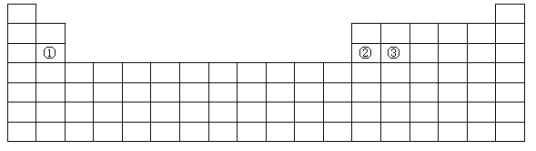
(1)在第2~5周期,处于金属元素与非金属元素分界线附近的非金属元素依次是____(填元素符号)。
(2)根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中______族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实______________________。
(3)比较上表中元素①与元素②的下列性质(填写“>”或“<”)。电负性:①_____②;第一电离能:①____________②。
(4)某短周期元素最高正价为+7,其原子结构示意图为__________________。
(5)基态原子③中,电子占据的最高能层符号_____,该能层具有的原子轨道数为____。
【答案】B Si As Te IVA H原子得到一个电子实现最外电子层稳定结构 < > 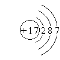 M 9
M 9
【解析】
(1)金属与非金属的分界线是非金属元素的硼、硅、砷、啼、砹与金属元素铝、锗、锑、钋之间的分界线,在第2~5周期,处于金属元素与非金属元素分界线附近的非金属元素依次是B、Si、 As、Te。
答案为:B Si As Te;
(2)最高正价与最低负价绝对值相等的族为ⅣA族;氢原子得到1个电子达到稳定结构,这一特点同ⅦA族元素相同。
答案为:IVA;H原子得到一个电子实现最外电子层稳定结构;
(3)由①和②在周期表中的位置可确定①、②分别为Mg和Al,其价电子排布式分别为3s2和3s23p1。利用同周期元素的递变规律可知:原子半径:Mg>Al,金属性:Mg>Al,电负性:Al>Mg,根据价层电子排布式镁更稳定,第一电离能Mg>Al
答案为:<;>;
(4)因短周期元素最高正价为+7的元素应为ⅦA族元素,氟元素无正价,所以该元素为氯元素。其原子结构示意图为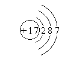 。
。
答案为: ;
;
(5)基态原子③为Si元素,核外电子排布式为1s22s22p63s23p2,电子占据的最高能层符号M,该能层含有s、p、d能级,分别含有的轨道数为1、3、5,具有的原子轨道数为9。
答案为:M;9


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
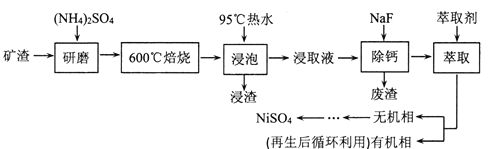
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
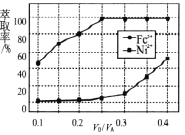
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。
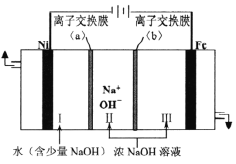
①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下: ![]() (g)
(g)![]()
 (g)+H2(g) △H=+17.6kJ/mol。
(g)+H2(g) △H=+17.6kJ/mol。
(1)从温度和压强角度分析提高乙苯平衡转化率可采取的措施有___________。
(2)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:4),测得容器总压和乙苯转化率随时间变化结果如图所示。
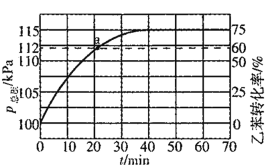
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数)
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的![]() ______。
______。
(3)CO2气氛下乙苯催化脱氢可同时存在图1两种途径:
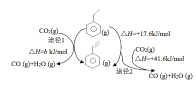
①b=_______kJ/mol。
②途径I的反应历程图所示,下列说法正确的是______________。
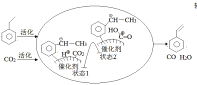
a.CO2为氧化剂
b.状态1到状态2形成了O-H键
c.中间产物只有(![]() )
)
d.该催化剂可提高乙苯的平衡转化率
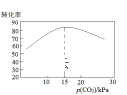
③在相同的容器中,不同p(CO2)的条件下,进行相同的反应时间,p(CO2)与乙苯转化率关系如图,分析,p(CO2)为15kPa时乙苯转化率最高的因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
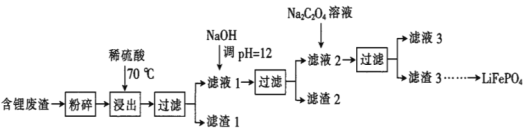
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
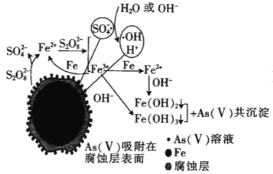
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是 ( )
①C(s)+O2(g)=CO2(g) △H1 、C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 、S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 、CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原的化合反应是
A.Na2CO3+CaCl2===CaCO3↓+2NaClB.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3![]() Na2CO3+CO2↑+H2OD.Na2O2+SO2===Na2SO4
Na2CO3+CO2↑+H2OD.Na2O2+SO2===Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原电池原理可以设计原电池,实现多种用途
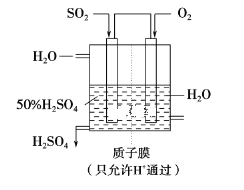
(1) 可以用如图所示装置吸收SO2并制取硫酸,写出通入SO2和O2的电极的电极反应式及反应的总方程式。
负极________________________________
正极________________________________
总反应_________________________________________。
(2) 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。
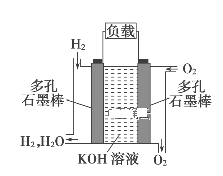
试回答下列问题:
①图中通过负载的电子流动方向________(填“向左”或“向右”)。
②写出氢氧燃料电池工作时电极反应方程式。
正极:_________________________,负极:____________________________,
③若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,
正极反应式为__________________________________________________;
负极反应式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
探究:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
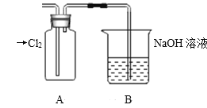
(1)装置A中盛放的试剂是____(填选项),化学反应方程式是___。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大④HCl的还原性比H2S弱⑤HClO4的酸性比H2SO4强 ⑥还原性:Cl-<S2- ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用元素周期律理论解释非金属性Cl>I的原因:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com