
可逆反应A(g)+B(g)
 C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行的最快的是( )
C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行的最快的是( )
A.v(A)=0.15 mol·L-1·min-1 B.v(B)=0.6 mol·L-1·min-1
C.v(C)=0.4 mol·L-1·min-1 D.v(D)=0.005 mol·L-1·s-1
科目:高中化学 来源: 题型:
关于原电池、电解池的电极名称,下列说法错误的是( )
A.原电池中失去电子的一极为负极
B.电解池中与直流电源负极相连的一极为阴极
C.原电池中相对活泼的一极为正极
D.电解池中发生氧化反应的一极为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
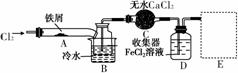
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为____________________________________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是____________________________________________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为____________________________________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:____________________________________________________________。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为____________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是( )
| 组号 | 反应温度/℃ | Na2S2O3 | H2SO4 | H2O | ||
| 体积/ mL | 浓度/ mol·L-1 | 体积/ mL | 浓度/ mol·L-1 | 体积/ mL | ||
| A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用如下图所示装置进行下列实验。
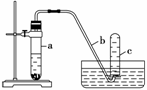
(1)在检查装置气密性后,向试管a中加入10 mL 6 mol·L-1硝酸和1 g Cu片,立即将带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式
________________________________________________________________________
________________。
(1) 实验过程中反应开始时速率缓慢,随后逐渐加快,这是由于
________________________________________________________________________,
当反应进行一段时间后速率又逐渐减慢,原因是
________________________________________________________________________
________________________________________________________________________。
(3)欲较快地制得NO,可采取的措施是( )
A.加热 B.使用铜粉 C.稀释HNO3 D.改用浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在体积为2 L的密闭容器中充入1 mol A和b mol B气体,发生如下反应:A(g)+B(g)
 2C(g),5 min后反应达平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
2C(g),5 min后反应达平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
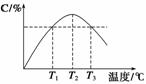
A.0~5 min,C物质的平均反应速率为0.04 mol·L-1·min-1
B.图中温度T1时的正反应速率等于温度T3时的正反应速率
C.该反应温度T2时的平衡常数大于温度T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
在N2(g)+3H2(g)
 2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
A.改变条件后速率—时间图象如右图: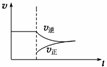
B.此过程中Q>K
C.平衡体系中NH3的含量增大
D.N2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
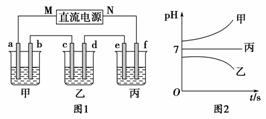
(1)M为直流电源的________极,b电极上发生的电极反应为__________________________________________________________。
(2)计算e电极上生成的气体在标准状况下的体积为________。
(3)写出乙烧杯中的总反应的离子方程式:__________________________________________________________。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,H2SO3HSO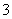 +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com