
氮化碳结构如图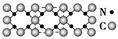 ,其中β?氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是( )
,其中β?氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是( )
A.氮化碳属于原子晶体
B.氮化碳中碳显-4价,氮显+3价
C.氮化碳的化学式为C3N4
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
氮化碳结构如右图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是( )
A.氮化碳属于原子晶体
B. 氮化碳中碳显—4价,氮显+3价
C.氮化碳的化学式为C3N4
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 ,则COCl2分子内含有_____个π键,C原子的杂化方式为____。
,则COCl2分子内含有_____个π键,C原子的杂化方式为____。 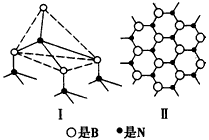

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com