
分析 无色溶液中一定不含MnO4-;
①取适量试液,加入过量盐酸,有气体生成,并得到溶液,说明一定含CO32-、CO32-与Ba2+、Al3+反应产生沉淀,一定不含Ba2+,Al3+;
②在①所得溶液中加入HNO3酸化的AgNO3,出现白色沉淀,由于①中引入氯离子,故不能判断此溶液中一定含有Cl-;
③取另一支试管,先加入过量的HCl酸化,再加入过量的NaHCO3溶液,有气体生成同时析出白色沉淀甲,甲的质量为3.9g,说明溶液中一定含有AlO2-,沉淀甲为氢氧化铝,且物质的量为0.05mol;
④在③所得溶液中加入过量的Ba(OH)2溶液,有白色沉淀乙析出,氢氧化钡和过量的碳酸氢钠溶液反应生成碳酸钡沉淀,或者与原溶液中的硫酸根生成硫酸钡沉淀,依据电中性原则得出,溶液中一定含有:Na+,据此解答即可.
解答 解:无色溶液中一定不含MnO4-;
①取适量试液,加入过量盐酸,有气体生成,并得到溶液,说明一定含CO32-、CO32-与Ba2+、Al3+反应产生沉淀,一定不含Ba2+,Al3+;
②在①所得溶液中加入HNO3酸化的AgNO3,出现白色沉淀,由于①中引入氯离子,故不能判断此溶液中一定含有Cl-;
③取另一支试管,先加入过量的HCl酸化,再加入过量的NaHCO3溶液,有气体生成同时析出白色沉淀甲,甲的质量为3.9g,说明溶液中一定含有AlO2-,沉淀甲为氢氧化铝,且物质的量为0.05mol;
④在③所得溶液中加入过量的Ba(OH)2溶液,有白色沉淀乙析出,氢氧化钡和过量的碳酸氢钠溶液反应生成碳酸钡沉淀,或者与原溶液中的硫酸根生成硫酸钡沉淀,依据电中性原则得出,溶液中一定含有:Na+,
(1)溶液中一定不存在的离子是:Ba2+,Al3+,MnO4-,
故答案为:Ba2+,Al3+,MnO4-;
(2)依据分析可知:一定存在的是:Na+、AlO2-、CO32-,
故答案为:Na+、AlO2-、CO32-;
(3)向沉淀中加入过量HCl,全部溶解沉淀为碳酸钡,部分溶解沉淀为碳酸钡与硫酸钡的混合物,
故答案为:向沉淀中加入过量HCl,全部溶解沉淀为碳酸钡,部分溶解沉淀为碳酸钡与硫酸钡的混合物;
(4)碳酸根与氢离子反应生成二氧化碳气体与水,偏铝酸根与氢气反应生成铝离子和水,离子反应方程式为:CO32-+2H+=CO2↑+H2O,AlO2-+4H+=Al3++2H2O,
故答案为:CO32-+2H+=CO2↑+H2O;AlO2-+4H+=Al3++2H2O;
(5)依据分析可知:溶液中一定含有AlO2-,3.9g氢氧化铝的物质的量为:$\frac{3.9g}{78g/mol}$=0.05mol,则原溶液中每份含AlO2-物质的量为0.05mol,则原溶液中含AlO2-物质的量0.1mol,
故答案为:AlO2-;0.1mol.
点评 本题考查了物质检验,离子反应的性质应用,反应现象的分析判断,注意加入过量试剂的作用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 6:3:2 | B. | 1:2:3 | C. | 3:6:2 | D. | 2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发结晶时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,溶液的液面高于滤纸的边缘 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从上口倒到另一个烧杯中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应发生时不必加热,吸热反应都需要加热后才能发生 | |
| B. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 | |
| C. | 化学反应一定有能量变化,当△H为“-”时,表示该反应为吸热反应 | |
| D. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ正(NH3)=υ正(H2S) | B. | υ正(NH3)=υ逆(H2S) | C. | υ逆(NH3)=υ逆(H2S) | D. | υ(NH3)=υ(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
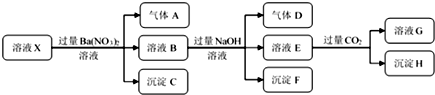
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3,工业上往BaCO3中加入饱和的Na2CO3可以实现BaSO4的转变 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com