
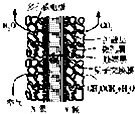
 二甲醚(CH3OCH3)可作为洁净的液体化石燃料,以CO和H2为原料生产二甲醚的一种工艺主要发生以下三个反应:
二甲醚(CH3OCH3)可作为洁净的液体化石燃料,以CO和H2为原料生产二甲醚的一种工艺主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-91kJ?mol-1 | K1 |
| ② | 2CH3OH(g)?CH2OCH3(g)+H2O(g)△H1=-24kJ?mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H1=-4kJ?mol-1 | K3 |
| 1 |
| 5 |
| 1 |
| 5 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、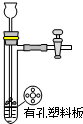 装置用于Na2SO3和浓H2SO4反应制取少量的SO2气体 |
B、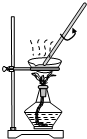 装置用于灼烧CuSO4?5H2O |
C、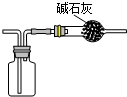 装置用于收集氯气并防止污染空气 |
D、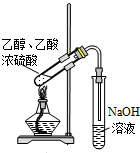 装置用于实验室制备少量乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中流经外电路的电子数目为0.1NA |
| B、在标准状况下,两极共产生3.92L气体 |
| C、电解后溶液的pH为2(假设溶液体积不变) |
| D、加入13.8g Ag2CO3可将溶液彻底复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
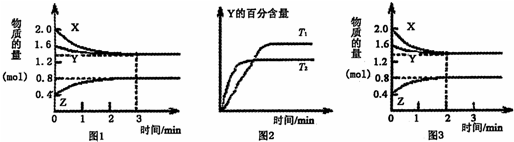
| A、容器中发生的反应可表示为:3X(g)+Y(g)?4Z(g) |
| B、0-3 min内,v(X)=0.2 mol?L-1?min-1 |
| C、若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
| D、其他条件不变升高温度,v正、v重都增大,且重新达到平衡前v正>v重 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K= | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙>K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.30 | 0.30 | 0.30 |
| A、v(H2)=3v(CO2)、v逆(CO2)=v正(CH3OH) |
| B、升高温度或减小压强均可使平衡常数增大 |
| C、0~3s内用H2表示的平均反应速率是0.05mol?L-1?s-1 |
| D、增大CO2浓度或选择适当的催化剂均能使该反应的反应速率增大,且平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性:K>Na>Li |
| B、热稳定性:HI>HCl>HF |
| C、非金属性:F>O>N |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com