
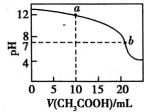
已知NH4Cl浓度小于0.1mol/L时,溶液PH>5.1现用0.1mol/L HCl溶液来滴定10mL 0.05mol/L氨水,用甲基橙作指示剂,达到终点时所用盐酸的体积( )
A.=10mL B.=5mL C.>5mL D.<5mL
科目:高中化学 来源: 题型:
 常温下有下列四种溶液:
常温下有下列四种溶液:| 序号 | ① | ② | ③ | ④ | 溶液 | pH=4的NH4Cl溶液 | pH=4的盐酸 | 0.1mol?L-1的醋酸溶液 | 0.1mol?L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5Na |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 物质 | CH3OH | CHO3CH3 | H2O |
| 浓度/mol/L | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑦ | B、①③⑤⑥ | C、②④⑥⑦ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑦ | B、③④⑤ | C、②④⑦ | D、①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:填空题
(1)室温下在pH=12的NaCN溶液中,由水电离的c(OH—)为 mol•L—1。
(2)浓度为0.1mol•L—1的下列各物质的溶液中,c(NH4+)由大到小的顺序是___(填序号)。
①NH4Cl ②NH4HSO4 ③NH3•H2O ④CH3COONH4
(3)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H+ +HA—,HAˉ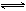 H+
+A2—。
H+
+A2—。
①则Na2A溶液显____性;NaHA溶液显 性(填“酸性”、“中性”或“碱性”)。
②若有0.1mo1•L—1Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
A.c(Na+)>c(A2—)>c(OH—)>c(HA—)>c(H+)
B.c(Na+)> c(OH—)>c(HA—)> >c(A2—) > c(H+)
C.c(Na+)> c(H+)> c(A2—)> c(OH—)>c(HA—)
D.c(A2—)>c(Na+)> c(OH—) > c(H+)>c(HA—)
(4)在含有Cl—、Br—、I—的溶液中,已知其浓度均为0.1mo1/L,已知AgCl、AgBr、AgI的溶度积分别为1.6×10—10、4.l×10—15、1.5×10—16,若向混合溶液中逐滴加入AgNO3溶液,试回答:
①当AgBr沉淀开始析出时,溶液中Ag+浓度是 。
②当AgC1沉淀开始析出时,溶液中的Br—、I—是否完全沉淀 (当溶液中离子浓度小于1.0×10—5mo1/L时,认为已经沉淀完全,本空选填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com