
���Ṥҵ�ڹ�����ռ�м�����Ҫ�ĵ�λ��
��1����ҵ������ʱ�������������Ҫ�ɷ�ΪFeS2��������Ԫ�صĻ�����Ϊ ��
��2�������������������ǻ��ʹ�ҵ������������ij��������� (��дһ��)��
��3�����������У����ݻ�ѧƽ��ԭ����ȷ�����������ʩ�� (��д���)��
A����ʯ�������¯֮ǰ�ȷ��� B��ʹ��V2O5������
C��ת������ʹ�����˵��¶� D���������¯����Ҫ�й����Ŀ���
E���������ڳ�ѹ�½��� F������������98.3%��Ũ��������SO3
��4�������Ṥҵ�У�ͨ�����з�Ӧʹ��������ת��Ϊ��������
2SO2(g)��O2(g) 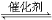 2SO3(g)����H����98.3 kJ��mol��1
2SO3(g)����H����98.3 kJ��mol��1
��ʵ�ʹ�ҵ�����У������á���ת����������������һ��ת�����ɵ�SO2�����δת����SO2���ж���ת������������SO2��ת���ʾ�Ϊ95%��������SO2��ת����Ϊ ��
��5������Ĺ�ҵ�Ʒ������漰������Ҫ�Ļ�ѧ��Ӧ����Ӧ���豸(����¯��ת������������))��
�������豸�ֱ�ʹ��Ӧ��֮����������������ˡ�����������������������з�Ӧ��֮�������������ġ�____________________________________________________________________��
�ڹ�ҵ�����г��ð����ᷨ����β�������Դﵽ������Ⱦ���������õ�Ŀ�ġ��û�ѧ����ʽ��ʾ�䷴Ӧԭ����(ֻд��2������ʽ����)
______________________________________________________________________
_____________________________________________________________________��
��6��ʵ���ҿ��������᳧¯��(��Ҫ�ɷ�Ϊ���������P����FeS��SiO2��)�Ʊ��������̷�(FeSO4•7H2O)�������Ļ�ѧʽΪ[Fe2(OH)n(SO4)3��0.5n]m���Ʊ�������ͼ��ʾ������˵����ȷ���� ��

A��¯����FeS������������ķ�Ӧ�����ӷ���ʽΪ��4FeS+3O2+12H+�T4Fe3++4S��+6H2O
B������M�ijɷ���SO2��ͨ��˫��ˮ�õ����ᣬ��ѭ��ʹ��
C������ҺX�м���������ۣ���ַ�Ӧ����˵õ���ҺY���ٽ���ҺY�����ᾧ���ɵõ��̷�
D����ҺZ��pHӰ�������������������������pHƫС�������¾�����������������ƫ��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ������
���ֶ�����Ԫ�صIJ��������������£�
Ԫ�� | T | X | Y | Z | W |
ԭ�Ӱ뾶��nm�� | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
�����ͻ��ϼ� | +1 | +5��3 | +7��1 | +6��2 | +3 |
��1��Z���ӵĽṹʾ��ͼΪ ��
��2������Y��Z����Ԫ�أ�����������ȷ���� ������ţ���
a�������ӵİ뾶 Y > Z
b����̬�⻯����ȶ���Y�� Zǿ
c������������Ӧˮ���������Z��Yǿ
��3��������T��X����Ԫ���γɵ�10 e�����ӣ�������Y��W����Ԫ���γɵĻ����ijͬѧ�������ͼ��ʾװ�ã��г�����ʡ�ԣ�����ʵ�飬����Ũ��Һ��μ��뵽NaOH�����У���ƿ�м��мų���ԭ���� ��һ��ʱ��۲쵽�Թ��е������� ��������Ӧ�����ӷ���ʽ�� ��
��4��T��X����Ԫ���γ�XT5���壬��������Ժ�ӵ�����㶼������Ӧϡ������ԭ�ӵ������ṹ���������ʽΪ_____��
��5��XO2�ǵ��¹⻯ѧ�����ġ�������ס�֮һ����������������Һ���յĻ�ѧ����ʽ�ǣ�2XO2 + 2NaOH = M + NaXO3 + H2O������ƽ��������M��Ԫ��X�Ļ��ϼ�Ϊ ��
��6�������£�Z2Y2��һ�ֳȻ�ɫҺ�壬�㷺������ҵ����������ӽṹ��˫��ˮ�������ơ���д����ṹʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������������ѧ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й��ڳ���ص�����������ȷ���� �� ��
A������ؿ���ͨ���ŵ硢���ʵ�ֻ�ѧ�ܺ͵��ܵ��ת��
B���ŵ�ʱ��������������Ӧ�����ʱ�õ缫�������ʷ����õ��ӵķ�Ӧ
C���ִ�����ʹ�õ����ƱȽ��Ƚ�����ط������ٽ�����������
D������صĻ�ѧ��Ӧԭ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����е�ʮУ����3���������ۻ�ѧ�Ծ��������棩 ���ͣ������
��ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO(g)+ 2H2(g) CH3OH(g) ��H
CH3OH(g) ��H
��1����֪CO(g)��H2(g)�ı�ȼ���ȷֱ�Ϊ-285.8kJ•mol-1��-283.0kJ•mol-1��
��CH3OH(g)+3/2O2(g)  CO2(g)+2H2O(l) ��H=��761kJ/mol��
CO2(g)+2H2O(l) ��H=��761kJ/mol��
��CO(g)+ 2H2(g) CH3OH(g)�ġ�H= ��
CH3OH(g)�ġ�H= ��
��2�����������ʵ�����CO��H2������������º����ܱ������н���������Ӧ��������ʵ��˵���˷�Ӧ�Ѵﵽƽ��״̬���� ��
A�������������ܶȱ��ֲ��� B����������ƽ����Է�����������
C������CH3OH������������H2��������� D��CO������������ֲ���
��3�����д�ʩ�м�����������÷�Ӧ�ķ�Ӧ������������COת���ʵ��� ��
A����CH3OH��ʱ�ӻ�����з���
B�����ͷ�Ӧ�¶�
C������װ���г���H2
D��ʹ�ø�Ч����
��4�����ݻ�Ϊ2L�ĺ��������У��ֱ��о���Ӧ��300�桢350���400�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1mol)��COƽ��ת���ʵĹ�ϵ����ش�
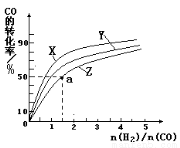
�������������¶��У�����X��Ӧ���¶���
������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���
CO(g)+ 2H2(g)  CH3OH(g) ��ƽ�ⳣ��K = ��
CH3OH(g) ��ƽ�ⳣ��K = ��
��5������������ͬʱ��ijͬѧ�о��ü״��ϳɷ�Ӧ�ڲ�ͬ�������������·�Ӧ��ͬʱ��ʱ��CO��ת�����淴Ӧ�¶ȵı仯�����������ͼ�в���t���ı仯�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�����е�ʮУ����3���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��W��MΪԭ��������������Ķ���������Ԫ�ء���֪����Ԫ�ض�Ӧ��ԭ�Ӱ뾶��СΪ��X<Z<Y<M<W����Y������л���ı�ҪԪ�� ��Z��X���γ����ֳ����Ĺ��ۻ������W���γ����ֳ��������ӻ�̨���M�ĵ��Ӳ�����������������ȡ�����˵������ȷ����( )
A��W��M�����Ӱ뾶������������Ӧˮ����ļ��Խ�ΪM��W
B��YZ 2Ϊֱ���͵Ĺ��ۻ����W2Z2�Ⱥ������Ӽ��ֺ��й��ۼ�
C��Y��X�γɵĻ�������۷е�һ������Z��X�γɵĻ�������۷е�
D��Z��M�γɵĻ��������Ϊ���²��ϣ�W��M��X��1:1:4��ɵĻ�������Ӧ��ǰ���ܹ㷺�Ĵ�����ϣ����к�ǿ�Ļ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ������������Ӧ�Կ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��W�Ƕ���������Ԫ�أ�Xԭ�������������Ǵ�����������YԪ���ڵؿ��еĺ�����࣬ZԪ�صĽ�������ǿ��Wԭ�ӵĺ����������Xԭ����Zԭ�ӵĺ��������֮�͡�����������ȷ����
A��X��Y���⻯���ͬ���⻯��ķе����
B��X��Y��Z�γɵĻ����ﲻֹһ��
C��ԭ�Ӱ뾶�Ĵ�С˳��r(W)>r(Z)>r(Y)>r(X)
D��Y��Z��W�γɵĻ�������ֻ�����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ�����ڰ˴�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
����ѧ����ѡ��3�����ʽṹ�����ʡ��ܣ�Co��������������Ԫ�ء����ܻ�������Ϊ���ϣ������ƾõ���ʷ���ڻ�е���졢���Բ��ϵ�����Ҳ���й㷺��Ӧ�á�
��ش��������⣺
��1��Co��̬ԭ�ӵĵ����Ų�ʽΪ ��
��2��̪ݼ�ܽ������ڹ����ϡ������Թ�ѧ���ϡ����ѧ�Ʒ��еĹ������������ȷ���õ��˹㷺��Ӧ�á���ṹ��ͼ��ʾ����������Ϊ�����ӡ�
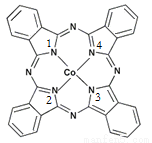
��̪ݼ�������ַǽ���ԭ�ӵĵ縺���ɴ�С��˳��Ϊ ��������Ӧ��Ԫ�ط������𣩣�̼ԭ�ӵ��ӻ��������Ϊ ��
����������ͨ����λ����ϵĵ�ԭ�ӵı���� ��
��3��CoCl2�нᾧˮ��Ŀ��ͬ���ֲ�ͬ����ɫ��
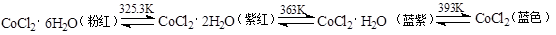
CoCl2�����ӵ��轺��һ�ָ��������ɺ����������ʹ�ã����Ƴɱ�ɫ�轺�������轺������CoCl2�����ã� ��
��4����KCN������Co2+������Һ���к�ɫ��Co(CN)2�������������ڹ�����KCN��Һ��������ɫ��[Co(CN)6]4-���������Ӿ���ǿ��ԭ�ԣ��ڼ���ʱ����ˮ��Ӧ���ɵ���ɫ[Co(CN)6]3-��д���÷�Ӧ�����ӷ���ʽ�� ��
��5��Co��һ��������ľ�������ͼ��ʾ���ڸþ�������һ����ԭ�ӵȾ������������ԭ����_________�����������Ͽ�ѧ����ʵ����һ������С�鷢������ 5K �³��ֳ����Եľ��壬�þ������CoO2�IJ�״�ṹ(����ͼ��ʾ��С���ʾCoԭ�ӣ������ʾOԭ�ӣ��������ô��������ظ��ṹ��Ԫʾ��ͼ��������CoO2�Ļ�ѧ����� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ�����ڶ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
Ϊ��Ԥ����ȱ��֢�����ҹ涨ÿǧ��ʳ����Ӧ����40��50 mg����ء�����ؾ�����нϸߵ��ȶ��ԣ�����������Һ�У��������һ�ֽ�ǿ�����������ܸ�ijЩ��ԭ����Ӧ���ɵ⣻�ڼ�����Һ�У�������ܱ�������������ȸ�ǿ������������Ϊ���۵ĵ�ĺ������Ρ���ҵ��������ص�������ͼ��ʾ��
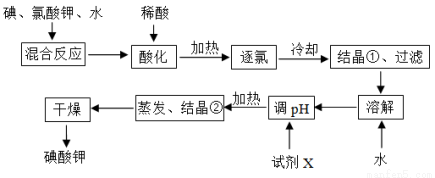
��1���������ڱ��е�λ��Ϊ__________________��
��2���⡢����ء�ˮ��Ϸ�Ӧʱ�������ֻ�ԭ�������õ��ӵ���Ŀ��ͬ������ƽ�÷�Ӧ�Ļ�ѧ����ʽ��____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2����
��3����Ϸ�Ӧ����ϡ���ữ��������___________________________����ϡ�����ϡ�����в���ѡ�õ�����_________��������__________________________________��
��4���Լ�X�Ļ�ѧʽΪ__________��д�����Լ�X��pH�Ļ�ѧ����ʽ__________________��
��5�����ʡ�ԡ��ữ���������ȡ������ᾧ�١����ˡ�������������ֱ�����Լ�X������Ӧ������pH���������������ʲôӰ�죿________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ����������ɽ���и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����豸����ʱ������ѧ��ת��Ϊ���ܵ���
A | B | C | D |
|
|
|
|
��̫���ܵ�� | ����ӵ�� | ̫���ܼ����� | ȼ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com