
【题目】下列说法与盐类的水解有关的是![]()
①明矾和![]() 可作净水剂;
可作净水剂;
②实验室盛放![]() 、
、![]() 等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞;
等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞;
③长期施用硫酸铵,土壤酸性增强;
④![]() 与
与![]() 溶液可作焊接中的除锈剂;
溶液可作焊接中的除锈剂;
⑤草木灰与铵态氮肥不能混合施用;
⑥用![]() 与
与![]() 两种溶液可作泡沫灭火剂。
两种溶液可作泡沫灭火剂。
A.①④B.②⑥C.③⑤D.全部
【答案】D
【解析】
①明矾中的铝离子水解得到的氢氧化铝胶体和氯化铁中的铁离子水解的到的氢氧化铁胶体均具有净水作用,所以明矾和FeCl3可作净水剂,与盐类的水解有关,故①正确;
②Na2CO3、Na2SiO3等溶液由于弱酸阴离子水解导致溶液显示碱性,可以和玻璃的成分二氧化硅反应,所以盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞,与盐类的水解有关,故②正确;
③硫酸铵中铵根离子水解导致溶液显示酸性,长期施用硫酸铵,土壤酸性增强,与盐类的水解有关,故③正确;
④NH4Cl与ZnCl2溶液显酸性,可以和铁锈的成分氧化铁反应,所以NH4Cl与ZnCl2溶液可作焊接中的除锈剂,与盐类的水解有关,故④正确;
⑤草木灰(碳酸钾)与铵态氮肥(铵盐)混合施用,铵根离子和碳酸根离子双水解生成挥发性的二氧化碳和氨气,所以不能混合使用,会降低肥效,与盐类的水解有关,故⑤正确;
⑥NaHCO3与Al2(SO4)3两种溶液混合,碳酸氢根离子和铝离子发生双水解反应,会迅速产生二氧化碳,与盐类的水解有关,故⑥正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】NaClO2 是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2 的工艺如下:

已知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·33H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为______________________。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___________________________④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(ClO2-被还原为Cl-杂质不参加反应),加入2~3滴淀粉溶液,用0.25molL﹣1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度_________________________(提示:2Na2S2O3+I2=Na2S4O6+2NaI)
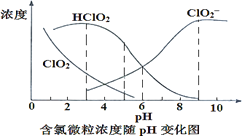
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定 25℃各含氯微粒浓度随 pH 的变化情况如图所示(Cl-没有画出)
①酸性条件下NaClO2溶液中存在Cl-的原因是_______________________(用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 的△H<0 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)sp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列体系中,离子可能大量共存的是![]()
A.滴加KSCN显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B.常温下,水电离出的![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C.使酚酞试剂显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D.加入Al能产生![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2被称为“空中死神”,其对环境的危害常表现为_______________。为了减少危害,人们进行了许多有益的探索和研究,并且在实际应用上取得了一定的成果。
(1)工业上常用生石灰来处理煤炭中的SO2,这是利用了SO2属于_______氧化物的性质。
(2)近年来,有人提出了一种利用电解饱和氯化钠溶液,循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:
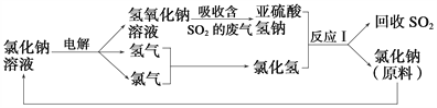
①此种方法中,可以循环利用的物质是_____________________________。
②写出反应Ⅰ的离子方程式:_____________________________________。
(3)SO2通过下列工艺流程可制备化工原料H2SO4和清洁能源H2
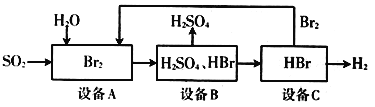
下列说法中正确的是____________ 。
A. 设备A中的溴水褪色,体现了SO2的漂白性
B. 该生产工艺的优点:Br2可以循环利用,并获得清洁能源H2
C. 该工艺流程的总反应方程式为:SO2+2H2O=H2SO4+H2
D. 设备B中物质分离操作为过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是()
A. 氧化铜与稀硝酸反应:CuO + 2H+ ![]() Cu2+ + H2O
Cu2+ + H2O
B. 稀 H2SO4与铁粉反应:2Fe + 6H+ ![]() 2Fe3+ + 3H2↑
2Fe3+ + 3H2↑
C. 盐酸滴在石灰石上:2H++ CO32— ![]() H2O +CO2↑
H2O +CO2↑
D. 硫酸氢钠与过量氢氧化钡反应:Ba2++2OH—+ 2H+ +SO42—![]() BaSO4↓+ 2H2O
BaSO4↓+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的 或
或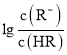 与pH变化的关系如图所示。下列叙述正确的是
与pH变化的关系如图所示。下列叙述正确的是![]()
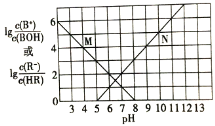
A.M线表示 随pH的变化
随pH的变化
B.BR溶液呈碱性
C.若温度升高,两条线均向上平移
D.常温下,![]() 溶液的
溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将![]() 、NO、
、NO、![]() 混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内
混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内![]() 的物质的量浓度的大小范围是( )
的物质的量浓度的大小范围是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是
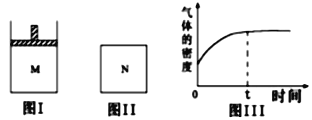
A. x=4
B. 若N中气体的密度如图Ⅲ所示,则A、B可能都是气态
C. 若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com