
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、CH3COO-、NO3-、SO42- |
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④⑤ | C. | ②③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol 氖气含有的原子数为2NA | |
| C. | 27g Al与足量的盐酸反应失去的电子数为3NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液的AG=1 | |
| B. | 常温下0.1 mol•L-1NaOH溶液的AG=12 | |
| C. | 酸性溶液的AG<0 | |
| D. | 常温下0.1 mol•L-1盐酸溶液的AG=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 | |
| B. | 用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 | |
| C. | 蒸馏水和0.1mol•L-1 NaOH溶液中的c(H+),前者大于后者 | |
| D. | 向含有少量Fe3+的MgCl2酸性溶液中加MgCO3,可将Fe3+转化成Fe(OH)3除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、I-、CO32-、Fe3+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Mg2+、Cl-、Ca2+ | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
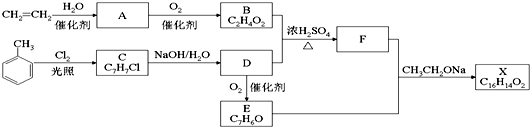
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ .B和D反应生成F的化学方程式
.B和D反应生成F的化学方程式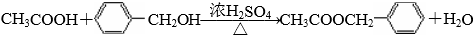 .D→E的化学方程式2
.D→E的化学方程式2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. .
. CH2OCH2CH2CHO B.
CH2OCH2CH2CHO B. CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3 D.CH2=CHCH=CHCH=CHCH=CHCOOH.
COOCH2CH2CH3 D.CH2=CHCH=CHCH=CHCH=CHCOOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com