
【题目】(1)已知在常温常压下:
①CH3CH2OH(l)+3O2(g) ═ 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②H2O(g) ═ H2O(l) ΔH2=-44kJ·mol-1
③CH3CH2OH(l)+2O2(g)═2CO(g)+3H2O(l) ΔH3=-932kJ·mol-1
写出CO燃烧热的热化学方程式 ____________。
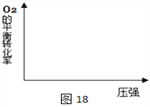
(2)在图18中画出不同温度下(T1>T2),上述反应③中O2的平衡转化率随压强变化的关系图(请在图上标注温度T1、T2)。________
(3)一定条件下,在体积为2 L的密闭容器中发生反应:CO(g) + 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
①该反应的平衡常数表达式K=__________;根据图19判断,升高温度,平衡常数K值将_____(填“增大”、“减小”或“不变”)。
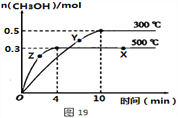
②500℃时,从反应开始至达到化学平衡,以H2的浓度变化表示的化学反应速率是____。
③X点与Y点的平均速率:v(X)____v(Y);其中X点的正反应速率v正(X)与Z点的逆反应速率v逆(Z)的大小关系为v正(X)____v逆(Z)(填“>”、“<”、“=”)。
(4)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。
①已知常温时,0.1mol/L的甲酸溶液其pH约为2.4,请用离子反应方程式表示甲酸钠的水溶液呈碱性的原因_________。
②向20mL 0.1mol/L的甲酸钠溶液中小心滴加10mL 0.1mol/L的盐酸,混合液呈酸性,请按由大到小的顺序给溶液中离子浓度排序_________。
【答案】 CO(g) +1∕2 O 2 (g)= CO 2 (g) △H =-283kJ·mol-1 
![]() 减小 0.075mol·L-1·min-1 < > HCOO- +H2O
减小 0.075mol·L-1·min-1 < > HCOO- +H2O ![]() HCOOH+ OH- C(Na+)>C(HCOO-)>C(Cl-)>C(H+)>C(OH-)
HCOOH+ OH- C(Na+)>C(HCOO-)>C(Cl-)>C(H+)>C(OH-)
【解析】(1)已知①CH3CH2OH(l)+3O2(g)2CO2(g)+3H2O(g)△H1=-1366kJmol-1,②H2O(g)=H2O(l)△H2=-44kJmol-1,③CH3CH2OH(l)+2O2(g)2CO(g)+3H2O(l)△H3=-932kJmol-1,利用盖斯定理,将①+②×3-③可得2CO(g)+O2(g)=2CO2(g)△H=(-1366kJmol-1)+(-44kJmol-1)×3-(-932kJmol-1)=-566kJmol-1,则CO燃烧热的热化学方程式为CO(g) +![]() O 2 (g)= CO 2 (g) △H =-283kJ·mol-1 ;
O 2 (g)= CO 2 (g) △H =-283kJ·mol-1 ;
(2)对反应CH3CH2OH(l)+2O2(g)═2CO(g)+3H2O(l) ΔH3=-932kJ·mol-1 ,温度越高反应速率越快,但升高温度平衡逆向移动,O2的转化率降低,则相应的图像为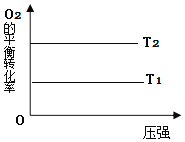 ;
;
(3)①因化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,所以K=![]() ,由图可知,升高温度,甲醇的含量降低,平衡逆向移动,则化学平衡常数减小;
,由图可知,升高温度,甲醇的含量降低,平衡逆向移动,则化学平衡常数减小;
②由图象可知,在500℃时,4min到达平衡,甲醇的平均反应速率v(CH3OH)= =0.0375mol(Lmin)-1,由速率之比等于化学计量数之比求出,则v(H2)=2v(CH3OH)=2×0.0375mol(Lmin)-1=0.075mol(Lmin)-1;
=0.0375mol(Lmin)-1,由速率之比等于化学计量数之比求出,则v(H2)=2v(CH3OH)=2×0.0375mol(Lmin)-1=0.075mol(Lmin)-1;
③X点为平衡状态,平均反应速率为0,则X点与Y点的平均速率:v(X)<v(Y);在相同温度下,浓度大反应速率快,X点甲醇的浓度大于Z点,则v正(X)>v逆(Z);
(4)①甲酸钠是强碱弱酸盐,水解呈碱性,所以水溶液呈碱性,离子反应方程式表示其原因HCOO-+H2OHCOOH+OH-;
②向20mL0.1mol/L的甲酸钠溶液中滴加10ml0.1mol/L的盐酸,得到等物质的量浓度的甲酸、甲酸钠和氯化钠的混合液,以甲酸的电离为主,溶液呈酸性,溶液中离子浓度从大到小的顺序为c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-)。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是
A. 均采用水浴加热 B. 均采用边反应边蒸馏的方法
C. 制备乙酸乙酯时乙醇过量 D. 制备乙酸丁酯时正丁醇过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护自然环境,提高人民的生活质量,必须重视处理“白色污染”。该“白色污染”指的是( )
A. 冶炼厂的白色烟尘B. 石灰窑的白色粉末
C. 聚氯乙烯等塑料垃圾D. 白色建筑材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(见下图),下列说法正确的是( )

A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、HNO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及的盐类物质均可与Ca(OH)2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 光导纤维的主要成分为二氧化硅 B. SiO2是酸性氧化物,它不溶于任何酸
C. SiO2的俗名叫水玻璃,不溶于水 D. Si在自然界中既有游离态又有化合态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一。
(1)利用海水脱琉可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:

天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是___________________,氧化后的海水需要加入NaOH,与之混合后才能排放。该操作的主要目的是_________________。
(2)利用氯碱工业产品来处理含SO2的烟气的流程如图所示:

①“吸收装置”中发生反应的离子方程式_____________________。
②上述流程中循环利用的物质是____________________。
(3)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。

①通入空气吹出Br2,并用Na2CO3吸收的目的是______________________;
②反应③中每生成3molBr2,转移电子的物质的量为__________mol;
③为了除去工业Br2中微量的C12,可向工业Br2中_____________(填字母)。
a.通入HBr b.加入NaBr溶液
c.加入Na2CO3溶液 d.加入Na2SO3溶液
(4)从海水中提纯粗盐后的母液中含有K+、 Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁:
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是__________________;
②电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_____________(填字母)。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )

A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种无色剧毒气体,沸点为-89.7℃,易自燃,与空气混合爆炸,微溶于水。其制取原理类似于实验室制氨气,现用下图装置来制取磷化氢并验证其性质。
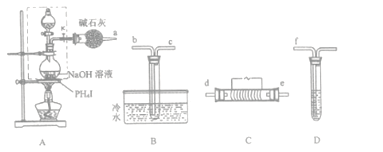
实验开始时,先从分液漏斗向盛有PH4I的圆底烧瓶中加入过量乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2(SO4)3反应),微热数分钟后再从分液漏斗向圆底烧瓶中加入一定量的浓NaOH溶液继续加热。在装置C处用电热器控制温度在300℃左右,实验过程中可观察到:B装置的试管中有白色蜡状固体生成;D装置的试管中Fe2(SO4)3溶液颜色由棕黄色变成淡绿色,同时也有白色蜡状固体生成。请回答:
(1)按气流方向连接装置,从左到右的顺序为:
a→______→ → → →f
(2)检查A中虚线框内装置的气密性的方法是____
(3)用PH4I和烧碱反应制取PH3的化学方程式是_____________。
(4)实验开始时,先向圆底烧瓶中加入乙醚并微热数分钟,其目的是__________。
(5)装置C中反应的化学方程式是____________;装置D中反应的离子方程式是_____________。
(6)装置B、D中的现象说明PH3具有的化学性质是_________(填字母序号)。
A.碱性 B.不稳定性 C.还原性 D.酸性
(7)实验时处理尾气的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形酮可用作荧光指示剂和酸碱指示剂。其合成方法为
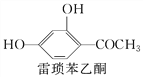

下列说法不正确的是( )
A. 雷琐苯乙酮、苹果酸和伞形酮各1 mol与足量Na反应生成H2体积之比为2∶3∶1
B. 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应
C. 1 mol雷琐苯乙酮跟足量H2反应,最多消耗4 mol H2
D. 1 mol伞形酮与足量NaOH溶液反应,最多消耗2 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com