
【题目】如图是甲烷(CH4)和白磷(P4)分子的空间结构示意图,请把你认为是化学键的虚线改为实线,把碳原子涂成实心小圆点(在图上改即可__________)。甲烷分子是________(填“左”、“右”)图。从图中看出,每个甲烷分子中有________对共用电子,而白磷分子中形成______个共价键,键角为________。甲烷是由________键(填“极性”或“非极性”,下同)形成的________分子,白磷是由________键形成的________分子。
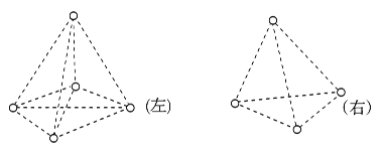
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
下列说法不正确的是
A. 滤液A中的阳离子为Fe2+、H+
B. 样品中铁元素的质量为2.24 g
C. 样品中CuO的质量为4.0 g
D. V=448 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年6月20日,2016年全球最受关注的十大化学成果发布,其中有两项与空气中的二氧化碳处理利用技术有关。其一为美国伊利诺斯大学芝加哥分校和阿贡国家实验室科学家联合设计的新型太阳能电池,可直接把大气中的二氧化碳转化为合成气(CO和H2)该设计同时具有环保和经济价值,不仅可以减缓二氧化碳的排放,而且可以生成重要的化工原料。
(1)下列材料也可以用于制造太阳能电池的是____________。
A.Ag2O B.Fe3O4 C.Si D.SiO2
(2)下图装置可实现二氧化碳到一氧化碳的转化
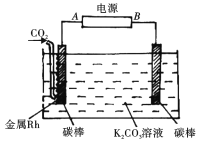
①电源的正极为______(“A”或“B")。
②阴极发生反应的电极方程式为:___________.
(3)CO 和H2可用于合成甲醇。
①已知CO、H2、CH3OH(1)的燃烧热为283.0kJ/mol、285.8kJ/mol、726.5kJ/mol,写出 由CO和H2制备CH3OH(1)的热化学方程式__________。
②在398K,1L的恒容容器中充入0.1molCO和0.2molH2,发生反应CO(g)+2H2(g) ![]() CH3OH(g),反应过程中气体的压强如下表所示(atm为标准大气压)。
CH3OH(g),反应过程中气体的压强如下表所示(atm为标准大气压)。
时间(min) | 0 | 1 | 5 | 10 | 30 | 50 |
压强(atm) | 10 | 9.3 | 8.0 | 7.2 | 4 | 4 |
该温度下的平衡常数是_____。达到平衡后,向该容器中通入0.05mol的气态CH3OH,再次达到平衡时,CH3OH的体积分数比原平衡时_____( 填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1LH2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol·L-1,则理论上最多能溶解铜的物质的量为
A. 0.80mol 0.72molB. 0.45molC. 0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)甲醇是重要的化工原料,CO和CO2均可用于合成甲醇。用CO2来生产甲醇的反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
(1)已知:
2CO(g)+O2(g)=2CO2(g) △H2
2H2(g)+O2(g)=2H2O(g) △H3
则CO(g)+ 2H2(g)=CH3OH(g) △H4=_______
(2)由CO合成甲醇时,CO的平衡转化率与温度和压强的关系如图所示。P点和Q点的平衡常数的大小KP____ KQ (填“大于”、“小于”或“等于”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________________。

(3)一定温度下,向2 L密闭容器中加入1 mol CH3OH(g),发生反应CH3OH(g) =CO(g)+ 2H2(g),CO的体积分数随时间的变化如图所示。

①反应达到平衡状态的标志是___________。
A.气体的密度不变
B.气体的压强保持不变
C.υ正(CH3OH)=2υ正(H2)
D.υ正(H2)=2υ逆(CO)
②该温度下,CO(g)+ 2H2(g)=CH3OH(g)的平衡常数K=_________。
③若在t1时刻再加入1mol CH3OH(g),在t2 时刻重新达到平衡,请在图上画出CO的体积分数随时间变化的曲线(不要求计算具体数值,画出变化的趋势和范围即可)_______。
(4)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池。负极的电极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用于简单有机化合物的制备、分离、提纯常见的简易装置。请根据该装置回答下列问题:
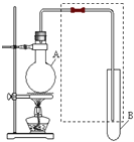
(1)若用C3H8O(醇)与乙酸反应生成酯类化合物,则在烧瓶A中加入C3H8O(醇)与乙酸外,还应加入的试剂是 ___________,试管B中应加入 ____________,虚线框中的导管作用是 ______________
(2)分子式为C3H8O的有机物在一定条件下脱水生成的有机物可能有 ________种;
(3)若用该装置分离乙酸和1-丙醇,则在烧瓶A中加入1-丙醇与乙酸外,还应先加入适量的试剂 ____(填化学式),加热到一定温度,试管B中收集到的是(填写结构简式) _____,冷却后,再向烧瓶中加入试剂 ______ (填名称),再加热到一定温度,试管B中收集到的是 _____(填写分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B. 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C. 常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D. 100g46%(质量分数)乙醇溶液中所含O-H数目为7NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com