
| A. | SO2的转化率为60% | |
| B. | SO3的产率为60% | |
| C. | 平衡时总压强与起始压强之比为7:8 | |
| D. | 平衡时V(SO2):V(O2):V(SO3)=3:3:1 |
分析 若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则
2SO2+O2?2SO3,
开始 6 6 0
转化 3 1.5 3
平衡 3 4.5 3
结合转化率=$\frac{转化的量}{开始的量}$×100%及物质的量比等于压强比计算.
解答 解:若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则
2SO2+O2?2SO3,
开始 6 6 0
转化 3 1.5 3
平衡 3 4.5 3
A.SO2的转化率为$\frac{3mol/L}{6mol/L}$=50%,故A错误;
B.理论上完全转化生成SO3的浓度为6mol/L,则产率为$\frac{3mol/L}{6mol/L}$=50%,故B错误;
C.平衡时总压强与起始压强之比为$\frac{3+4.5+3}{6+6}$=7:8,故C正确;
D.平衡时V(SO2):V(O2):V(SO3)=3:4.5:3=2:3:2,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率的计算等为解答的关键,侧重分析与计算能力的考查,注意物质的量与压强的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Cl-的物质的量浓度为2mol/L | |
| B. | CaCl2的物质的量为1mol | |
| C. | 取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L | |
| D. | 该溶液中水的体积为100 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热煮沸后未出现砖红色沉淀 | 验证X结构中不含有醛基 |
| B | 在混有少量苯酚的苯中滴加足量溴水,充分振荡后过滤 | 除去苯中少量的苯酚 |
| C | 溴乙烷与NaOH溶液加热至不再分层,冷却后加稀硝酸至酸性,再滴加AgNO3溶液 | 验证卤素原子为溴原子 |
| D | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 | 检验气体中含有乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
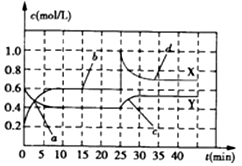
| A. | 前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(L•min) | |
| B. | 反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g) | |
| C. | 若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g) | |
| D. | a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 | |
| D. | 溶液中c(H+)越大,pH也越大,溶液的酸性就越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  图可表示对平衡N2(g)+3H2(g)?2NH3(g)加压、同时移除部分NH3时的速率变化 | |
| B. |  图中a、b曲线只可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 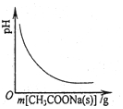 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 | |
| D. | 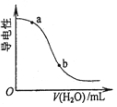 图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | x | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
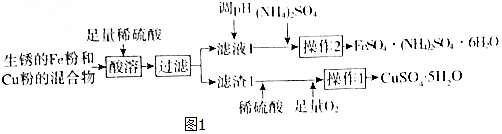
| FeSO4•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
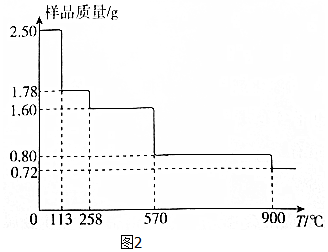
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=1000Wρ/M | B. | m=VρW/100 | C. | W%=cM/1000ρ% | D. | c=100m/VM |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com