
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 大气中二氧化碳含量的增多是造成“温室效应”的主要原因 |
分析 A.气溶胶为胶体分散系,胶体具有丁达尔效应;
B.铁置换铜属于湿法炼铜;
C.对青蒿素的提取利用的是萃取原理;
D.温室效应是由二氧化碳引起的.
解答 解:A.雾霾所形成的气溶胶属于胶体,具有丁达尔效应,故A正确;
B.铁置换铜属于湿法炼铜,该过程发生了置换反应,故B正确;
C.对青蒿素的提取利用的是萃取原理,萃取过程中没有新物质生成,属于物理变化,故C错误;
D.温室效应是由二氧化碳引起的,二氧化碳含量的增多导致了温室效应的加剧,故D正确.
故选C.
点评 本题考查物质性质、物质成分、物质变化等知识点,为高频考点,明确物质组成、性质、用途关系是解本题关键,会根据物质性质解释其用途,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
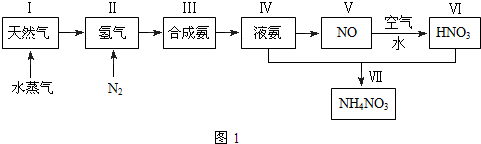
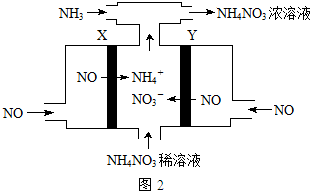
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
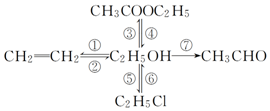 写出下列各物质相互转化的化学方程式,并说明各步的反应类型.
写出下列各物质相互转化的化学方程式,并说明各步的反应类型.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
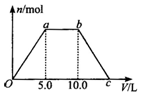 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
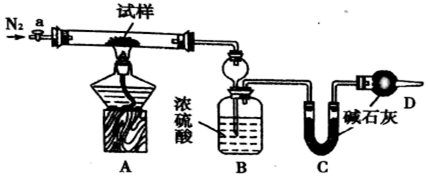
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
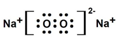
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2O | CO | CO2 | H2 | |
| 甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| 乙 n/mol | 0.20 | 0.20 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②③ | C. | ①② | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com