


科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、仅①② | B、仅①②③ |
| C、仅①②④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol?L-1.该温度下反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数K=
(1)T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol?L-1.该温度下反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数K=查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
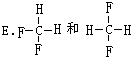
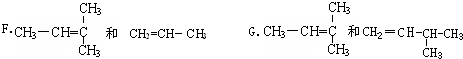
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
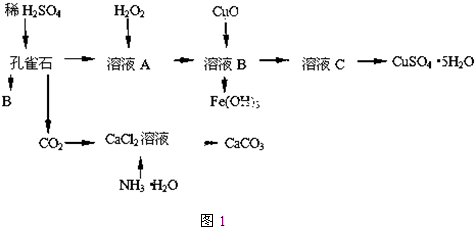
科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
 氯化钠是我们日常生活的必需品,也是重要的化工原料,可以制备一系列物质.氯化钠的用途如图所示,下列说法错误的是( )
氯化钠是我们日常生活的必需品,也是重要的化工原料,可以制备一系列物质.氯化钠的用途如图所示,下列说法错误的是( )A、NaHCO3受热分解的方程式为:2NaHCO3
| ||||
| B、Cl2与Ca(OH)2的反应中,Cl2作氧化剂,Ca(OH)2作还原剂 | ||||
| C、Cl2与过量的Fe反应的产物为FeCl3 | ||||
D、电解熔融态氯化钠的方程式为:2NaCl
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com