�»����żӴ�2010��10��31�յ磺ӡ�������ǻ����������������?����ŵ��ӡ�����żӴ�˵��10��25�������Ŵ���ʡ������Ⱥ������ĵ���ХĿǰ����ɽ�450������������96��ʧ�٣�Ϊȷ������֮�����ߣ����ط��߲���ʹ���˺�����������������ClO2��һ������ɱ��Ч�ʸߵ�����������ǿ�����ԣ���ҵ��ClO2����NaClO3��Na2SO3��Һ��ϲ���H2SO4�ữ��Ӧ�Ƶã����йش˷�Ӧ��˵����ȷ���ǣ� ��
A��NaClO3�ǻ�ԭ��
B�������ԣ�ClO2��NaClO3
C����ѧ��Ӧ����ʽΪ��2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O
D��1 mol NaClO3�μӷ�Ӧ��2 mol e-ת��
���𰸡�
���������������д����ѧ��Ӧ����ʽ2NaClO
3+Na
2SO
3+H
2SO
4=2ClO
2+2Na
2SO
4+H
2O����Ӧ��
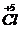
��
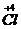
���õ��ӣ�NaClO
3����ԭ��SԪ�ػ��ϼ����ߣ���������
Na
2SO
3Ϊ��ԭ������ϻ��ϼ۵�����������Ƚ����⣮
����⣺A����Ӧ��
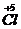
��
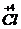
���õ��ӣ�NaClO
3����ԭ����A����
B����Ӧ���������������Դ�����������������ԣ�ӦΪNaClO
3��ClO
2����B����
C��NaClO
3��Na
2SO
3��Һ��ϲ���H
2SO
4�ữ��Ӧ�Ƶ�ClO
2����Ӧ�ķ���ʽΪ2NaClO
3+Na
2SO
3+H
2SO
4=2ClO
2+2Na
2SO
4+H
2O����C��ȷ��
D����Ӧ��
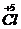
��
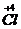
��1 mol NaClO
3�μӷ�Ӧ��1 mol e
-ת�ƣ���D����
��ѡC��
���������⿼��������ԭ��Ӧ��ע���Ԫ�ػ��ϼ۱仯�ĽǶȽ����⣬��Ŀ�Ѷ��еȣ��״���ΪC��ע����ݷ�Ӧ������������غ�Ķ�����д��



 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�