
| A. | 氯水中:2c(Cl2)═c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 25℃时,pH=12的NaOH溶液与pH=12的氨水;c(Na+)═c(NH4+) | |
| C. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(H+)═c(HCO3-) |
分析 A.由于氯气部分和水反应,溶液中存在氯气分子,不能确定反应的量的关系;
B.25℃时,pH=12的NaOH溶液与pH=12的氨水溶液中,氢氧根离子浓度相同,c(Na+)═c(NH4+);
C.pH=4的0.1 mol•L-1的NaHA溶液中,溶液显酸性,HA-离子电离程度大于水解程度;
D.分析溶液中电荷守恒、物料守恒、质子守恒判断;
解答 解:A.由于氯气部分和水反应,存在化学平衡Cl2+H2O?HCl+HClO,溶液中存在氯气分子,不能确定反应的量的关系,故A错误;
B.25℃时,pH=12的NaOH溶液中c(OH-)=c(Na+)═10-2mol/L,pH=12的氨水溶液中c(OH-)=c(NH4+)=10-2mol/L,氢氧根离子浓度相同,c(Na+)═c(NH4+),故B正确;
C.pH=4的0.1 mol•L-1的NaHA溶液中,HA-离子电离程度大于水解程度,离子浓度大小为:c(HA-)>c(H+)>c(A2-)>c(H2A),故C错误;
D.电荷守恒为:c(K+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),物料守恒c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),无法得到选项中离子浓度大小关系,故D错误;
故选B.
点评 本题考查了电解质溶液中离子浓度大小比较,弱电解质电离平衡,电解质溶液中电荷守恒、物料守恒、质子守恒分析方法,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
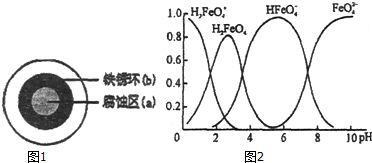
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
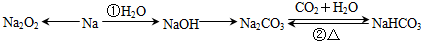
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )
可逆反应:mA(g)+nB(g)?eC(g)+fD(s),反应过程中,当其他条件不变时,C的体积分数[a(C)]在不同温度(T)和不同压强(P)的条件下随时间(t) 的变化关系如图,下列叙述正确的是( )| A. | 化学方程式中:m+n>e | |
| B. | 达到平衡后,使用催化剂,C的体积分数将增大 | |
| C. | 达到平衡后,若温度升高,化学平衡向逆反应方向移动 | |
| D. | 达到平衡后,若增大体系的压强,化学平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑥ | C. | ④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气除去乙烯 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,先加入稀硫酸酸化,再滴加硝酸银溶液 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 实验室制取乙炔时,常用饱和食盐水代替水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com